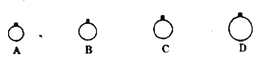题目内容
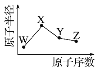
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是_____。

(2)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量,已知(见图):则1mol N﹣H键断裂吸收的能量约等于_____kJ。

(3)请将 Zn+2Ag+=2Ag+Zn2+设计成原电池,并画出简易装置图,并注明电极材料以及电解质溶液___。

【答案】D 391 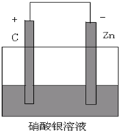
【解析】
(1)根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热;
(2)3H2+N22NH3,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
(3)根据 Zn + 2Ag+ = 2Ag + Zn2+,Zn发生氧化反应,所以Zn作负极,Ag+发生还原反应生成Ag,所以可溶性硝酸银作电解质溶液,用石墨作正极。
(1)A+B→C为放热反应,则A+B的总能量大于生成C的总能量,排除选项A、B,A+B→X(吸热),则X的能量大于A+B的总能量,X→C(放热),则X的能量大于C的总能量,排除选项C,
答案选D;
(2)工业合成氨反应为:3H2+N22NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=+391kJ;
(3)根据 Zn + 2Ag+ = 2Ag + Zn2+,Zn发生氧化反应,所以Zn作负极,Ag+发生还原反应生成Ag,所以可溶性硝酸银作电解质溶液,用石墨作正极,简易装置图如下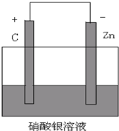 。
。

练习册系列答案
相关题目