题目内容
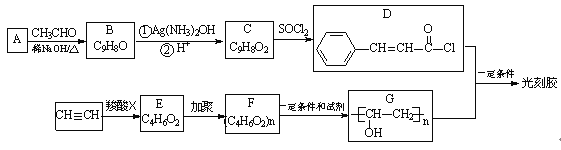
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
【答案】 CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O 长颈漏斗 饱和NaHCO3溶液 d a b f c e 钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成 加入足量BaCl2(或CaCl2 、Ba(NO3)2、Ca(NO3)2)溶液 (未写足量不得分) 滴入酚酞试液 (或紫色石蕊试液或用广泛pH试纸检测溶液pH) 6Na + 5CO2 ![]() 3Na2CO3 + C + CO (配平错误不得分)
3Na2CO3 + C + CO (配平错误不得分)
【解析】(1)A是大理石与稀盐酸制取二氧化碳的反应,离子方程式为CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O;(2)仪器X 的名称是长颈漏斗,B 中的溶液为饱和NaHCO3溶液,用于除去二氧化碳中的氯化氢气体;(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g,d.打开K1和K2,通入CO2至E 中出现浑浊,a.点燃酒精灯,加热,b.熄灭酒精灯,f.冷却到室温,c.关闭K1和K2,e.称量硬质玻璃管,重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。其正确顺序是d a b f c e;
(4)钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成,反应完全后,管中有大量黑色物质;(5)探究固体产物中元素Na 的存在形式:将硬质玻璃管中的固体产物溶于水后过滤,往步骤1所得滤液中加入足量BaCl2(或CaCl2 、Ba(NO3)2、Ca(NO3)2)溶液,滴入酚酞试液,溶液显红色,或紫色石蕊试液显蓝色,或用广泛pH试纸检测溶液pH大于7,则假设一成立;(6)反应前钠的质量为:m2- m1=69.0g-66.7g=2.3g,即0.1mol钠,若全部转化为碳酸钠,则碳酸钠的质量为:2.3g×![]() =5.3g,物质的量为0.05mol,反应后产物的质量为:m3- m1=72.1g-66.7g=5.4g,则还生成碳,且碳的质量为0.1g,即
=5.3g,物质的量为0.05mol,反应后产物的质量为:m3- m1=72.1g-66.7g=5.4g,则还生成碳,且碳的质量为0.1g,即![]() mol,结合质量守恒,钠和二氧化碳反应生成碳酸钠、碳,应该还生成一氧化碳,故反应方程式为:6Na + 5CO2
mol,结合质量守恒,钠和二氧化碳反应生成碳酸钠、碳,应该还生成一氧化碳,故反应方程式为:6Na + 5CO2 ![]() 3Na2CO3 + C + CO。
3Na2CO3 + C + CO。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21 。回答下列问题:
W | X | |||
Y | Z |
(1)X 在元素周期表中的位置为_______。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W的最简单氢化物的电子式为________________。
(4)W、Z 最高价氧化物的水化物酸性较强的为___________(填化学式)。
(5)Y单质与Fe2O3 反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为____________________。
(6)向盛有3 mL 鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为________________________________________。
(7)C3H7Z 的结构简式有____________________。
(8)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
【题目】在一定温度下,已知可逆反应X(g)+3Y(g) ![]() 2Z(g),甲、乙两个恒温恒容的密闭容器中各物质浓度如下表所示:
2Z(g),甲、乙两个恒温恒容的密闭容器中各物质浓度如下表所示:
X(g) | Y(g) | Z(g) | ||
容器甲 | 初始浓度(mol/L) | 2.5 | y | 0 |
平衡浓度(mol/L) | x | 2.0 | 1.0 | |
容器乙 | t时刻浓度(mol/L) | 3.0 | 2.0 | 2.0 |
下列有关正确的是
A. x=3.5,Y=3.5 B. 平衡常数为1/6
C. 乙容器t时刻v(正)(逆) D. 因温度相等,平衡常数相同,故容器甲与容器乙中反应能达到等效平衡状态