题目内容
【题目】某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
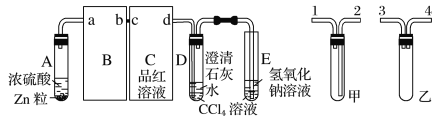
试回答下列问题:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:_________________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4的作用是_______________________________。
(3)能证明浓硫酸具有强氧化性的实验现象为___________________________________;反应较长时间后气泡量又会明显增加的原因是_________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
【答案】(1)Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O Zn+H2SO4(稀)===ZnSO4+H2↑
(2)3或4 4或3 2 1 防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4后,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
【解析】
(1)浓硫酸和锌反应生成硫酸锌、SO2和水。但随着反应的进行,硫酸的浓度逐渐降低,因此最后会生成氢气和硫酸锌,反应的方程式分别是Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O、Zn+H2SO4(稀)===ZnSO4+H2↑。
(2)由于SO2极易溶于水,所以B处应该是防倒吸的装置,所以选择是乙装置;C处是检验SO2的漂白性的,所以选择甲装置,因此正确的连接顺序是3或4 4或3 2 1。由于SO2极易溶于水,而四氯化碳的密度不溶于水,且在水的下层,所以D、E两支试管中CCl4溶液的作用是防倒吸。
(3)①证明浓硫酸具有强氧化性,数目反应中有SO2生成,因此现象是C中品红溶液褪色。
②随着反应的进行,浓H2SO4变成稀H2SO4后,与Zn反应放出H2,所以气体又逐渐增加。
(4)由于过量的SO2能和亚硫酸钙反应生成亚硫酸氢钙,因此又变澄清,反应的方程式是SO2+H2O+CaSO3===Ca2++2HSO。

【题目】硫化碱法是工业上制备Na2S2O3的方法之一,其反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O的流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ____________ ,表明SO2吸收效率低的实验现象是B中溶液 _________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 __________________ 。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)。
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, _________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
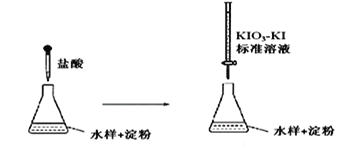
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量为214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步: 用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=_________mol·L-1。
已知:IO3-+5I-+6H+= 3I2+3H2O ,2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能__________(填“不受影响”、“偏低”或“偏高”),原因是_________________________________。(用离子方程式表示)。
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是

选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D
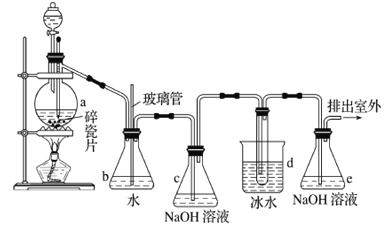
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
已知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升高到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是_______________________________________________;安全瓶b还可以起到的作用是__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。