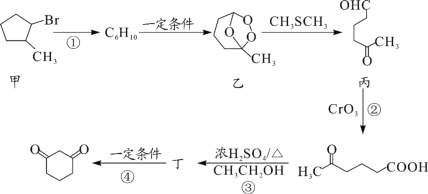
题目内容
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g);5min末达到平衡,有关数据如右表。
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(molL—1) | 2.0 | 1.0 | 0 |
平衡浓度(molL—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)="0.08" molL-1min-1
C.当容器中为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 molL—1
【答案】A
【解析】
A项、升高温度,反应的平衡常数减小,则平衡逆向移动,所以正反应为放热反应,故A错误;
B项、由题意建立如下三段式:
PCl3(g)+Cl2(g)![]() PCl5(g)
PCl5(g)
初始浓度/mol·L-1 2.0 1.0 0
转化浓度/mol·L-1 0.4 0.4 0.4
平衡浓度/mol·L-1 1.6 0.6 0.4
则v(PCl3)= ![]() mol·L-1·min-1=0.08"mol·L-1·min-1,故B正确;
mol·L-1·min-1=0.08"mol·L-1·min-1,故B正确;
C项、由上述三段式计算可知,c(Cl2)= 0.6 mol·L-1,n(Cl2)=1.2mol,故C正确;
D项、反应的化学平衡常数K=![]() =
=![]() ,平衡后移走2.0 mol PCl3和1.0 mol Cl2,c(PCl3)=0.6mol·L-1,c(Cl2)=0.1mol·L-1,由温度不变化学平衡常数不变可解得c(PCl5)=
,平衡后移走2.0 mol PCl3和1.0 mol Cl2,c(PCl3)=0.6mol·L-1,c(Cl2)=0.1mol·L-1,由温度不变化学平衡常数不变可解得c(PCl5)=
0.025 mol·L-1,故D正确;
故选A。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目