题目内容
【题目】I.燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入____极 (填a或b)。a极发生电极反应式为:____________
II.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下( 累计值,体积已换算成标准状态) :

(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_______ ,原因是______________
(2)哪一时间段的反应速率最小________,原因是_________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率( 设溶液体积不变)________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A. 蒸馏水 B. NaCl溶液C. Na2CO3溶液D. CuSO4溶液
可行的是(填编号)________
【答案】b 4H++O2+4e- =2H2O 2~3min 因该反应是放热反应,2~3min时温度高 4~5min 因为4~ 5min时H+浓度小 0.1mol·L-1·min-1 AB
【解析】
I.根据燃料电池的原理解析;
II.(1)先计算每个时间段的气体体积,然后根据相同条件下,气体体积与反应速率的关系判断反应速率大小,根据该反应与能量变化的关系判断速率变化原因;
(2)先计算每个时间段的气体体积,然后根据相同条件下,气体体积与反应速率的关系判断反应速率大小,根据浓度与化学反应速率的关系判断速率变化的原因;
(3)先求出气体的物质的量,然后计算盐酸变化的物质的量,利用速率公式计算即可;
(4)根据浓度、电解质的强弱对反应速率的影响判断。
I.现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;反应中氢气作还原剂,发生氧化反应,则氢气应通入b极。a为正极,氧气在酸性条件下得电子生成水,a极发生电极反应式为:4H++O2+4e- =2H2O,故答案为:b;4H++O2+4e- =2H2O;
II.0~1 min、1~2 min、2~3 min、3~4 min、4~5min,各时间段的气体体积分别为:50 mL、70mL、112 mL、58 mL、20 mL。
(1)相同通条件下,反应速率越大,相同时间内收集的气体越多;通过计算得,反应速率最大的时间段是2~3 min,;原因是:该反应是放热反应,温度越高,反应速率越大,故答案为:2~3min;因该反应是放热反应,2~3min时温度高;
(2)相同通条件下,反应速率越小,相同时间内收集的气体越少;通过计算得,反应速率最小的时间段是:4~5min;原因是:随着反应的进行,盐酸的浓度在减小,浓度越小,反应速率越慢,故答案为:4~5min;因为4~ 5min时H+浓度小;
(3)2~3 min生成氢气的体积是112 mL,得需要盐酸的物质的量为0.01mol。

所以v(HCl )=![]() =0.1mol·L-1·min-1,故答案为:0.1mol·L-1·min-1;
=0.1mol·L-1·min-1,故答案为:0.1mol·L-1·min-1;
(4)改变化学反应速率的方法有:改变溶液的浓度、改变溶液的温度、改变固体的表面积等。
A.加蒸馏水,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故A正确;
B.加NaCl溶液,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故B正确;
C.加Na2CO3溶液,溶液的体积增大,盐酸的浓度降低,但盐酸和碳酸钠反应生成二氧化碳,氢气的量减小,故C错误;
D.加CuSO4溶液,能形成铜锌原电池,加快反应速率,故D错误;
故答案为:AB。

【题目】根据图1、图2、图3及题中信息,回答下列问题
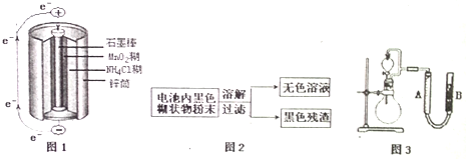
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 |
|
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g);5min末达到平衡,有关数据如右表。
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(molL—1) | 2.0 | 1.0 | 0 |
平衡浓度(molL—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)="0.08" molL-1min-1
C.当容器中为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 molL—1