题目内容
【题目】(1)①写出漂白粉的有效成分的化学式:________________
②写出甘氨酸的结构简式:_______________
(2)写出苯和浓硝酸在浓H2SO4催化作用下,50~60℃时生成硝基苯的方程式:_______________
(3)相对分子质量为58的烷烃,它可能的结构简式:_______________
【答案】Ca(ClO)2 CH2(NH2)COOH ![]() +HNO3
+HNO3![]()
![]() +H2O CH3CH2CH2CH3、CH3CH(CH3)CH3
+H2O CH3CH2CH2CH3、CH3CH(CH3)CH3
【解析】
(1)①漂白粉的成分是Ca(ClO)2和CaCl2,其有效成分是Ca(ClO)2;
②甘氨酸属于氨基酸,含有氨基和羧基,甘氨酸又名氨基乙酸,其结构简式为CH2(NH2)COOH;
(2)苯与浓硝酸发生硝化反应或取代反应,生成硝基苯,反应方程式为![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(3)烷烃的通式为CnH2n+2,相对分子质量为58的烷烃,因此有14n+2=58,解得n=4,该烷烃的分子式为C4H10,结构简式为CH3CH2CH2CH3、CH3CH(CH3)CH3。

【题目】根据图1、图2、图3及题中信息,回答下列问题
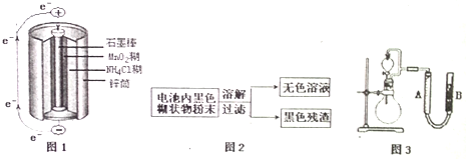
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 |
|
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g);5min末达到平衡,有关数据如右表。
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(molL—1) | 2.0 | 1.0 | 0 |
平衡浓度(molL—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)="0.08" molL-1min-1
C.当容器中为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 molL—1



