题目内容
【题目】某学习小组向50mLBa(NO3)2和Al(NO3)3的混合溶液M中逐滴加入K2SO4和KOH的混合溶液N,产生沉淀的物质的量(n)随加入溶液N的体积(V)变化的关系如图。下列说法错误的是( )
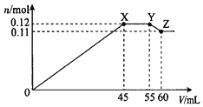
A.溶液N中K2SO4和KOH的物质的量浓度均为1molL-1
B.X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3
C.溶液M中含有0.11molBa(NO3)2和0.03molAl(NO3)3
D.Y点到Z点之间发生的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O
【答案】A
【解析】
硫酸钾发生反应:Ba2++SO42-=BaSO4↓,而KOH发生反应:Al3++3OH-=Al(OH)3↓,当KOH过量时,又发生反应:Al(OH)3+OH-=AlO2-+2H2O。由45~55mL沉淀量不变,而后沉淀又减小,可知该阶段由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,则:0~45mL阶段曲线生成的沉淀为BaSO4和Al(OH)3,且加入N溶液45mL时,Al3+恰好沉淀完全。加入N溶液55mL时,Ba2+恰好沉淀完全。55mL~60mL阶段Al(OH)3继续溶解。加入N溶液60mL时,沉淀中Al(OH)3已完全溶解。最终沉淀为BaSO4共0.11mol,据此解答。
A.0~45mL阶段曲线生成的沉淀为BaSO4和Al(OH)3,45~55mL阶段溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,假设溶解Al(OH)3为1mol,则生成BaSO4为1mol,由Al(OH)3+OH-=AlO2-+2H2O,可知消耗KOH为1mol,由Ba2++SO42-=BaSO4↓,可知消耗K2SO4为1mol,故溶液N中c(K2SO4):c(KOH)=1:1,55mL~60mL阶段Al(OH)3继续溶解。加入N溶液60mL时,沉淀中Al(OH)3已完全溶解,溶解0.01molAl(OH)3,c(KOH)=![]() =2mol/L,溶液N中K2SO4和KOH的物质的量浓度均为2molL-1,故A错误;
=2mol/L,溶液N中K2SO4和KOH的物质的量浓度均为2molL-1,故A错误;
B.加入K2SO4和KOH的混合溶液N45mL,溶液N中K2SO4和KOH的物质的量浓度均为2molL-1,消耗的物质的量都为2molL-1×0.045L=0.09mol,故X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3,故B正确;
C.60mL阶段沉淀中Al(OH)3已完全溶解,最终沉淀为BaSO4共0.11mol,根据钡离子守恒,溶液M中含有0.11molBa(NO3)2,根据铝原子守恒,有0.03molAl(NO3)3,故C正确;
D.Y点到Z点之间发生发生Al(OH)3溶解至完全,化学方程式为Al(OH)3+KOH=KAlO2+2H2O,故D正确;
故选:A。

【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L