题目内容
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
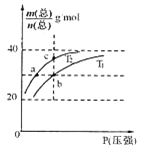
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
【答案】C
【解析】
A、根据平衡体系的总质量m(总)与总物质的量n(总)之比为混合气体平均摩尔质量可知,该反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量m(总)与总物质的量n(总)之比减小,可推知 T1>T2,故A错误;
B、平衡常数随温度变化,不随压强变化,温度越高,平衡正向进行,平衡常数增大,所以平衡常数: K(a)= K(c)<K(b),故B错误;
C、分析判断可以知道T1>T2,温度越高反应速率越快,反应速率: v(b)>v(a),故C正确;
D、设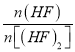 =x:y,根据
=x:y,根据![]() =
=![]() =30g·mol-1时,得x:y=1:1,故D错误;
=30g·mol-1时,得x:y=1:1,故D错误;
故选C。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目