题目内容
【题目】在2L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。达到平衡时NO的转化率为_______
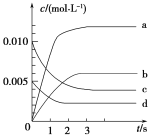
(2)能说明该反应已达到平衡状态的是________(填字母序号,下同)。
A.v (NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
A.增加容器体积 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
【答案】(1)b 1.5×10-3mol·L-1·s-1 65%
(2)bc
(3)bcd
【解析】
试题分析: (1)下图表示消耗NO 0.013mol,所以生成NO20.013mol,NO2的浓度是0.0065mo,表示NO2的变化的曲线是b。用O2表示从0~2 s内消耗NO 0.012mol,则消耗O2 0.006mol,该反应的平均速率v=![]() 1.5×10-3mol·L-1·s-1。达到平衡时NO的转化率为
1.5×10-3mol·L-1·s-1。达到平衡时NO的转化率为![]() =65%
=65%
(2)v (NO2)=2v(O2) 都是正反应速率,不一定平衡;反应前后气体物质的量是变量,容器内压强是变量,压强保持不变时一定平衡;
正逆反应速率比等于系数比,v逆(NO)=2v正(O2)一定平衡 ;![]() ,混合气体在质量是恒量,故密度是恒量,混合气体的密度不变时,不一定平衡。
,混合气体在质量是恒量,故密度是恒量,混合气体的密度不变时,不一定平衡。
(3)增加容器体积,反应物浓度减小,反应速率减慢;适当升高温度,反应速率加快;
增大O2的浓度,反应速率加快;选择高效催化剂能加快反应速率。

【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)





