题目内容
【题目】(物质结构与性质)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)元素B、G形成的单质熔点更高的是_ ___(填化学式),原因是____ _
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为 。
【答案】(1)1s22s22p63s23p63d74s2或[Ar]3d74s2
(2)Li; Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高
(3)非极性
(4)①③;直线型
(5)[Co(NH3)5SO4]Br
【解析】试题分析:根据元素周期表的结构,A—N元素分别为H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Cr、Co。
(1)N为Co元素,27号元素,根据核外电子排布规律,Co的基态原子电子排布式为[Ar]3d74s2。
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高,Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高。
(3)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2都是非极性溶剂,根据相似相溶原理,可判断ME2L2是非极性分子。
(4)①苯中每个碳原子只含3个σ键且没有孤电子对,所以属于sp2杂化;②CH3OH中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;③HCHO中碳原子含有3个σ键且没有孤电子对,所以属于sp2杂化;④CS2中碳原子含有2个σ键且没有孤电子对,所以属于sp杂化;⑤CCl4中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化,所以碳原子采取sp2杂化的分子有①③;CS2中碳原子属于sp杂化,其结构为S=C=S,属于直线型分子。
(5)加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体,加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,该配合物的结构式为[Co(NH3)5SO4]Br。

【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A元素的一种原子没有中子,只有一个质子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道有三个未成对电子 |
D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
回答下列问题。
(1)写出E元素原子基态时M层的电子排布式 。
(2)C元素单质分子中含有δ和π键的键数之比为 。
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是: 。
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有 (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为 (填序号)。
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)三硫化四磷是黄绿色针状结晶,其结构如图所示。
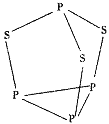
三硫化四磷分子中P原子采取____杂化,与PO3-互为等电子体的化合物分子的化学式为________。用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。