题目内容
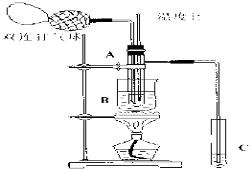
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
![]()
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为 (注明反应条件)。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________,目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是____________________。
(3)烧杯B的作用是___________________________,烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找)。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为 。
【答案】(1)2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(2)试管A的反应液中;测量反应溶液的温度;略低于试管A的支管口处;收集含乙酸的馏分;
(3)使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;乙二醇或甘油(只写一个);
(4)方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸。方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成
【解析】
试题分析:(1)乙醛与氧气发生氧化反应生成乙酸,方程式为:2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
(2)实验开始时温度计应测量反应的温度,控制反应温度为60℃~80℃,所以实验开始时温度计水银球的位置应在试管A的反应液中;由蒸馏原理可知,温度计测量的是蒸气的温度,所以温度计水银球的位置应在试管A的支管口处;
(3)乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油,B中装的液体直接受热,可以让试管A内的反应液均匀受热发生反应;
(4)乙酸能与碳酸氢钠粉末反应产生气泡:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;乙酸能使pH试纸变红:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成。

【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A元素的一种原子没有中子,只有一个质子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道有三个未成对电子 |
D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
回答下列问题。
(1)写出E元素原子基态时M层的电子排布式 。
(2)C元素单质分子中含有δ和π键的键数之比为 。
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是: 。
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有 (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为 (填序号)。
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)三硫化四磷是黄绿色针状结晶,其结构如图所示。
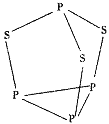
三硫化四磷分子中P原子采取____杂化,与PO3-互为等电子体的化合物分子的化学式为________。用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。