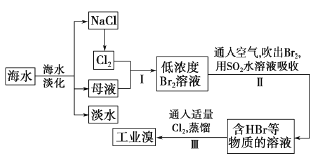
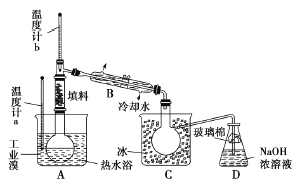
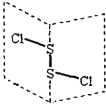
题目内容
【题目】同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4 >H2YO4>H3ZO4,则下列各判断中正确的是( )
A. 非金属性:X>Y>Z B. 原子半径:X>Y>Z
C. 气态氢化物稳定性:X<Y<Z D. 原子序数:X<Y<Z
【答案】A
【解析】试题分析:同周期从左向右金属性增强,其最高正价氧化物对应的水化物的酸性增强,最高正价由左向右增大,令X为Cl,Y为S,Z为P,A、根据上述推断,故正确;B、同周期从左向右,半径减小,P>S>Cl,故错误;C、非金属性越强,其氢化物越稳定,即Cl>S>P,故错误;D、同周期从左向右原子序数依次增大,即Cl>S>P,故错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
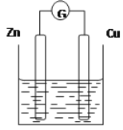
Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
(4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。