题目内容
【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
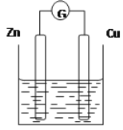
Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
(4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。
【答案】(1)③④⑤(2分,错一个得1分,错两个该空不得分)
(2)Zn片不纯,在Zn片上就能形成许多微小原电池(1分)(写出Zn片不纯即得分)
(3)不存在能自发进行的氧化还原反应(1分)(写出不会形成原电池即得分)
(4)铜极 (1分) Cu2++2e-=Cu(2分)。
【解析】
试题分析:(1)①在该原电池反应中,Zn是负极,Cu是正极,错误;②根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的H+向正极移动,错误;③电子由负极Zn经外电路流向正极Cu,正确;④溶液中的H+在正极Cu上获得电子变为氢气逸出,所以Cu极有H2,正确;⑤根据闭合回路中电子转移数目相对可知,若有1mol电子流过导线,则产生H2为0.5mol,正确;⑥Zn是负极,负极的电极反应式:Zn―2e―=Zn2+,错误。(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是Zn片不纯,在Zn片上就能形成许多微小原电池。(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是不存在能自发进行的氧化还原反应;(4)如果把硫酸换成硫酸铜溶液,锌为负极,失去电子,发生氧化反应,在正极上溶液的Cu2+获得电子变为单质Cu附着在电极上,使Cu电极变粗,用电极方程式表示Cu2++2e-=Cu。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】I、已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
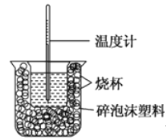
(1)该图中有两处未画出,它们分别是______、______。
(2)做一次完整的中和热测定实验,温度计需使用______次。
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1 △H2(填“>”“<”或“=”)。
②两组实验结果差异的原因是 。
③写出HCl和NH3H2O反应的热化学方程式: 。
II、如下图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
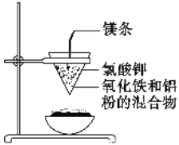
(1)写出该反应的化学方程式:__________,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿 ④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:________;镁条:________;氯酸钾:________。