题目内容
【题目】欲除去铁粉中的少量铝粉,应选用的试剂是( )
A.稀盐酸 B.稀硝酸 C.氨水 D.氢氧化钠溶液
【答案】D
【解析】
试题分析:铝粉与强碱溶液反应生成溶于水的偏铝酸钠,而铁与强碱不反应,由此分析解答.
铝粉与强碱溶液反应生成溶于水的偏铝酸钠,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以可加入NaOH溶液除去铁粉中的铝粉,盐酸、硝酸和铁与铝都反应,而氨水与两者都不反应,故选D.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】科学研究与工业生产中常常用到溶液中的反应。
(1)25℃时,0.05 mol·L-1Ba(OH)2溶液的pH= ,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为 。
(2)CO2可转化成有机物实现碳循环:CO2![]() CH3OH
CH3OH![]() HCOOH……
HCOOH……
25 ℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因 。
②物质的量浓度均为0.1 mol·L-1的下列四种物质:
a.Na2CO3 b.NaClO c.HCOONa d.NaHCO3 ,pH由大到小的顺序是 (填编号)。
(3)常温下,将0.2 mol·L-1的HCOOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度 HCOONa的水解程度(填“大于”“等于”或“小于”)。
(4)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
【题目】I、已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
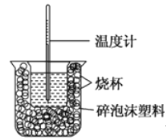
(1)该图中有两处未画出,它们分别是______、______。
(2)做一次完整的中和热测定实验,温度计需使用______次。
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1 △H2(填“>”“<”或“=”)。
②两组实验结果差异的原因是 。
③写出HCl和NH3H2O反应的热化学方程式: 。
II、如下图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
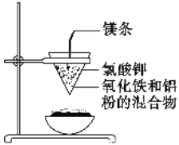
(1)写出该反应的化学方程式:__________,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿 ④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:________;镁条:________;氯酸钾:________。