题目内容
12.下列物质有多个官能团,其中既可看作醛类又可看作酯类的是( )| A. |  | B. |  | C. | 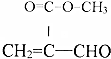 | D. | 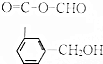 |
分析 醛类物质中含有官能团醛基:-CHO,酯类物质中含有官能团酯基:-COOC-,据此对各选项进行判断.
解答 解:A.该有机物分子中含有醛基,不含酯基,故A错误;
B.该有机物分子中含有醛基和酚羟基,不存在酯基,故B错误;
C.该有机物分子中含有醛基和酯基,故C正确;
D.该有机物为甲酸形成的酯,含有醛基,但是不属于醛类,故D错误;
故选C.
点评 本题考查了有机物官能团与分类的关系,题目难度不大,注意甲酸分子中含有醛基,但不属于醛类,明确常见有机物分类方法与官能团的关系为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4 g | 10 g | 141.1 g | |
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
20.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2含有的分子数为NA | |
| B. | 标准状况下,80g SO3的体积为22.4L | |
| C. | 18g H2O在标准状况下的体积是22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
5.单质硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450℃~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置图:

相关信息如下:①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
请回答下列问题:(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.装置C中的试剂是浓硫酸.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
(4)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ.但是装置Ⅰ、Ⅱ都有不足之处,请你设计一个合理方案并用文字表达:在装置Ⅰ的i处接干燥管j
(5)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO${\;}_{4}^{-}$+8H+=5Fe3++Mn2++4H2O 某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.(写出计算过程)

相关信息如下:①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | -57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
(4)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ.但是装置Ⅰ、Ⅱ都有不足之处,请你设计一个合理方案并用文字表达:在装置Ⅰ的i处接干燥管j
(5)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO${\;}_{4}^{-}$+8H+=5Fe3++Mn2++4H2O 某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.(写出计算过程)
12.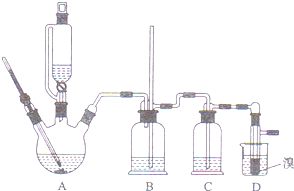 已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:有关数据列表如下:
回答下列问题:
(1)反应原理是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br
(2)在装置C中应加入c,(填正确选项前的字母)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)反应原理是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br
(2)在装置C中应加入c,(填正确选项前的字母)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.

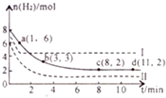 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.