题目内容
【题目】乙炔广泛用于焊接、焊割及有机合成等方面。
(1)已知下列热化学方程式:
4CH4 (g)+3O2(g)==2C2H2(g)+6H2O(g) △H1=a kJmol-1;
2H2(g)+O2(g)==2H2O(g) △H2=b kJmol-1;
2CH4(g)==C2H2(g)+3H2 (g) △H3
①△H3=____________________ (用含a、b的代数式表示)kJmol-1。
②已知下列共价健的键能数据:
共价键 | C—H | H—H | C |
键能/ kJmol-1 | 413.4 | 436 | 812 |
则△H3=____________________ (填数值)kJmol-1。
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为__________________________。
(3)向压强为1.0×104 kPa的恒压密闭容器中充入1 mol乙炔和1 mol HC1气体,在催化剂作用下乙炔与HC1发生反应:HC![]() CH(g)+HCl(g)
CH(g)+HCl(g)![]() CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。

①该反应的△H__________(填“>”或“<”)0,N点时乙炔的反应速率v(正)________(填“>”或“<” 或“=”) v(逆)。
② M点对应温度下,该反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(kPa)-1,
【答案】 ![]() +360.4 2CHCl3+6Ag
+360.4 2CHCl3+6Ag![]() HC
HC![]() CH↑+6AgCl < > 2.4×l0-3
CH↑+6AgCl < > 2.4×l0-3
【解析】(1)考查盖斯定律的应用以及反应热与键能的关系,①:①4CH4 (g)+3O2(g)=2C2H2(g)+6H2O(g),②2H2(g)+O2(g)=2H2O(g),
因此有(①-②×3)/2,即△H3=(a-3b)/2kJ·mol-1;②△H=反应物键能总和-生成物键能总和=2×4×413.4-(2×413.4+812+3×436)kJ·mol-1=+360.4kJ·mol-1;(2)考查化学反应方程式的书写,氯仿和金属银反应生成乙炔和氯化银,因此方程式为2CHCl3+6Ag![]() HC
HC![]() CH↑+6AgCl;(3)考查勒夏特列原理、化学平衡的计算,①根据图像,随着温度的升高,乙炔的平衡转化率降低,说明升高温度,平衡向逆反应方向移动,即正反应方向是放热反应,△H<0,此线为平衡线,平衡线上的每一个点达到平衡,N→M,乙炔转化率增大,即平衡向正反应方向进行,正反应方向速率大于逆反应方向速率;②
CH↑+6AgCl;(3)考查勒夏特列原理、化学平衡的计算,①根据图像,随着温度的升高,乙炔的平衡转化率降低,说明升高温度,平衡向逆反应方向移动,即正反应方向是放热反应,△H<0,此线为平衡线,平衡线上的每一个点达到平衡,N→M,乙炔转化率增大,即平衡向正反应方向进行,正反应方向速率大于逆反应方向速率;②
HC![]() CH(g)+HCl(g)
CH(g)+HCl(g)![]() CH2=CHCl(g)
CH2=CHCl(g)
起始: 1 1 0
变化: 0.8 0.8 0.8
平衡: 0.2 0.2 0.8,乙炔平衡时物质的量分数为0.2/1.2,氯化氢的物质的量分数为0.2/1.2,氯乙烯的物质的量分数为0.8/1.2,Kp=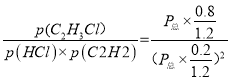 ,代入数值,解得Kp=2.4×10-3。
,代入数值,解得Kp=2.4×10-3。

 高中必刷题系列答案
高中必刷题系列答案
