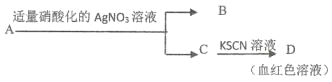
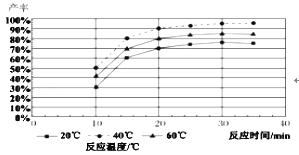
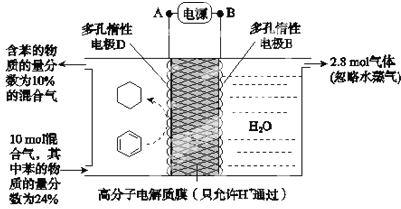
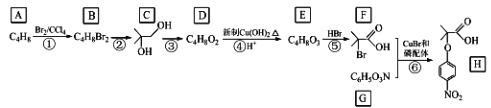
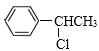
题目内容
【题目】钼(Mo)的主要用途是制造特种钢,用CO还原MoO3(白色粉末,加热时变黄)制备单质Mo的装置如图。下列说法正确的是

A.装置②中盛有饱和Na2CO3溶液,装置③中盛有浓硫酸,作用是净化CO2
B.装置①中的稀盐酸可用稀硫酸代替,石灰石可用碳酸钠粉末代替
C.装置④的作用是制备CO,装置⑤的作用是CO还原MoO3
D.装置⑥能达到检验MoO3是否被CO还原的目的
【答案】C
【解析】
①由稀盐酸和石灰石制备CO2,制得的CO2混有HCl和水蒸气,用②中饱和NaHCO3溶液吸收HCl,用③中浓硫酸吸收水蒸气,纯净干燥的二氧化碳与C在④中高温反应生成CO,CO与MoO3在装置⑤中反应制备单质Mo,⑥检验CO2,以此解答该题。
A.除去CO2中的杂质HCl,应用饱和NaHCO3溶液,A错误;
B.Na2CO3粉末易溶于水,不能用启普发生器制备二氧化碳气体,B错误;
C.由以上分析可知,装置④的作用是制备CO,装置⑤的作用是CO还原MoO3,C正确;
D.⑥中的CO2可能来源于④中未反应完的,故不能检验MoO3是否被CO还原,D错误;
故合理选项是C。

练习册系列答案
相关题目