题目内容
【题目】已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。D、E为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数等于A、B、C最高能层的p能级电子数之和。
回答下列问题:
(1)五种元素中,电负性最大的是________(填元素符号)。
(2)E常有+2、+3两种价态,画出E2+的价电子排布图:________________。
(3)与BC互为等电子体的分子、离子分别是______________________(各举1例),BC的结构式为______________(若有配位键,须用“→”表示出来),实验测得该分子的极性极弱,试从结构方面进行解释:________________________________________________。
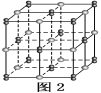
(4)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由2个H3AO3和2个[A(OH)4]-缩合而成的双六元环,应该写成Na2[A4O5(OH)4]·8H2O,其结构式如图1所示,它的阴离子可形成链状结构。
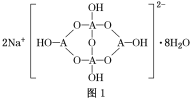
①A原子的杂化方式为________。
②Na2[A4O5(OH)4]·8H2O的阴离子由极性键和配位键构成,请在图中用“→”标出其中的配位键________。该阴离子通过________________相互结合形成链状结构。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因:________________________________________________________________________。
(5)E2+在水溶液中以[E(H2O)6]2+形式存在,向含E2+的溶液中加入氨水,可生成[E(NH3)6]2+,[E(NH3)6]2+更稳定,原因是_____________________________。
(6)由元素B、D组成的某离子化合物的晶胞结构如图2所示,则该物质的电子式为_____。若晶胞的长、宽、高分别为520 pm、520 pm和690 pm,该晶体的密度为________(保留小数点后两位数字)g·cm-3。
【答案】O ![]() N2、CN-(其他合理答案均可)
N2、CN-(其他合理答案均可) ![]() 分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性 sp2和sp3
分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性 sp2和sp3 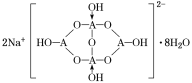 氢键 H3BO3+H2O=[B(OH)4]-+H+{或B(OH)3+H2O=[B(OH)4]-+H+} N的电负性小于O,N原子更易提供孤对电子形成配位键 Ca2+[
氢键 H3BO3+H2O=[B(OH)4]-+H+{或B(OH)3+H2O=[B(OH)4]-+H+} N的电负性小于O,N原子更易提供孤对电子形成配位键 Ca2+[![]() ]2- 2.28
]2- 2.28
【解析】
A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns2np2、ns2np4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co,据此分析计算。
根据上述分析,A为B元素、B为C元素、C为O元素,D为Ca元素,E为Co元素。
(1)非金属性越强,电负性越大,同周期自左而右,电负性增大,五种元素中,O元素电负性最大,故答案为:O;
(2)E为Co,常有+2、+3两种价态,Co2+离子的价电子排布图![]() ,故答案为:
,故答案为:![]() ;
;
(3)与CO互为等电子体的分子、离子分别是N2、CN-,CO的结构式为![]() ,分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性,使得该分子的极性极弱,故答案为:N2、CN-;
,分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性,使得该分子的极性极弱,故答案为:N2、CN-;![]() ;分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性;
;分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性;
(4)①A为B元素,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键,杂化轨道类型为sp2、sp3,故答案为:sp2、sp3;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: ,该阴离子通过氢键相互结合形成链状结构,故答案为:
,该阴离子通过氢键相互结合形成链状结构,故答案为: ;氢键;
;氢键;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子,用离子方程式表示为H3BO3+H2O[B(OH)4]-+H+,故答案为:H3BO3+H2O[B(OH)4]-+H+;
(5)Co2+离子在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+离子的溶液中加入氨水,可生成更稳定的
(6) 晶胞中钙离子、C22-数目相等,都为8×![]() +6×
+6×![]() =4,形成的离子化合物为CaC2,电子式为
=4,形成的离子化合物为CaC2,电子式为![]() ;晶胞质量为4×
;晶胞质量为4×![]() g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为
g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为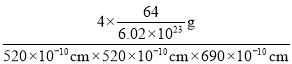 =2.28g/cm3,故答案为:
=2.28g/cm3,故答案为:![]() ;2.28。
;2.28。

 阅读快车系列答案
阅读快车系列答案【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
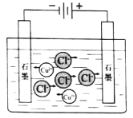
电解CuCl2溶液 |
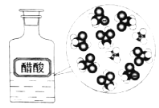
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
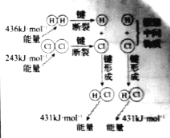
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D