题目内容
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及 CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
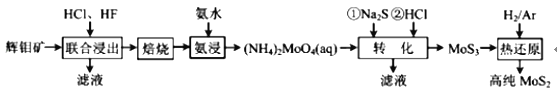
回答下列问题:
(1)(NH4)2MoO4中Mo的化合价为_____。
(2)“联合浸出”中HF除去的杂质化学式为_____,“焙烧”时MoS2转化为MoO3的化学方程式为_____。
(3)“转化”中加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出(NH4)2MoS4与盐酸生成MoS3的离子方程式_____。
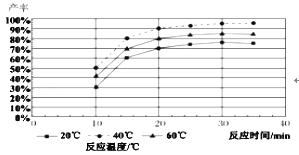
(4)由图分析产生MoS3沉淀的流程中应选择的最优温度和时间是_____,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____。
(5)高纯MoS2中存在极微量非整比晶体杂质MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为_____。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的 Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当SO42-完全沉淀时,溶液中c(MoO42-)<_____mol/L(保留2位有效数字)
【答案】+6 SiO2 2MoS2+7O2![]() 2MoO3+4SO2 MoS42-+2H+=MoS3↓+H2S↑ 40 ℃、30 min 温度太低不利于H2S 逸出;温度太高,盐酸挥发,溶液c(H+)下降,都不利于反应正向进行 1∶4 3.6×10-3
2MoO3+4SO2 MoS42-+2H+=MoS3↓+H2S↑ 40 ℃、30 min 温度太低不利于H2S 逸出;温度太高,盐酸挥发,溶液c(H+)下降,都不利于反应正向进行 1∶4 3.6×10-3
【解析】
制备高纯二硫化钼的流程为:辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)用盐酸、氢氟酸酸浸,除去CuFeS2、SiO2杂质,得到粗MoS2,将粗MoS2洗涤、干燥、氧化焙烧得到MoO3;再将MoO3氨浸得到(NH4)2MoO4;加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],再加入盐酸,(NH4)2MoS4与盐酸生成MoS3沉淀:MoS42-+2H+=MoS3↓+H2S↑,最后通过干燥、研磨,在氢气、Ar环境下高温获得高纯的二硫化钼MoS2。
(1)化学式中(NH4)2MoO4中,NH4+带一个单位正电荷,O元素为-2价,则Mo的化合价为+6价;
(2)氢氟酸可以与二氧化硅反应得到四氟化硅气体,从而除去SiO2杂质;焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2![]() 2MoO3+4SO2;
2MoO3+4SO2;
(3)(NH4)2MoS4在溶液中电离出NH4+和MoS42-,MoS42-与盐酸电离产生的H+作用生成MoS3,则另外的生成物是H2S气体,反应的离子反应方程式为:MoS42-+2H+=MoS3↓+H2S↑;
(4)由图象得到40℃的产率最高,30分钟以后产率不再变化,所以产生MoS3沉淀选择d 最优条件是40℃,30min;温度太低,反应MoS42-+2H+=MoS3↓+H2S↑产生的H2S气体不易逸出,不利于生成MoS3;若温度太高,盐酸挥发,导致溶液c(H+)下降,也不利于生成MoS3,所以最优温度为40℃;
(5)设在1 mol的MoS2.8中Mo4+与Mo6+的物质的量分别是x和y,则x+y=1,根据化合价代数之和为0,则有4x+6y=2.8×2,解得x=0.2,y=0.8,所以该杂质中Mo4+与Mo6+的物质的量之比为0.2:0.8=1:4;
(6)已知:Ksp(BaSO4)=1.1×10-10< Ksp(BaMoO4)=4.0×10-8,所以先沉淀的是BaSO4,则当BaMoO4开始沉淀时,BaSO4已经沉淀完全,所以溶液对于两种沉淀来说都是饱和的,其中的离子浓度都符合沉淀的Ksp表达式: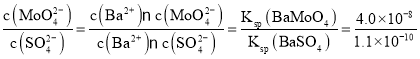 =360=3.6×102,则当SO42-完全沉淀时,溶液中c(SO42-)<1×10-5 mol/L,c(MoO42-)<3.6×102×1×10-5 mol/L=3.6×10-3 mol/L。
=360=3.6×102,则当SO42-完全沉淀时,溶液中c(SO42-)<1×10-5 mol/L,c(MoO42-)<3.6×102×1×10-5 mol/L=3.6×10-3 mol/L。

 阅读快车系列答案
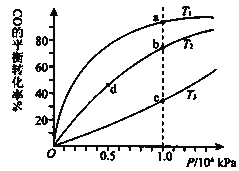
阅读快车系列答案【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
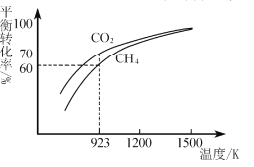
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
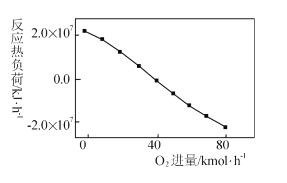
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________