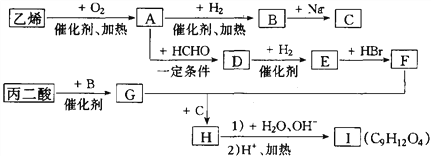
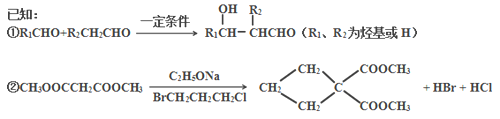
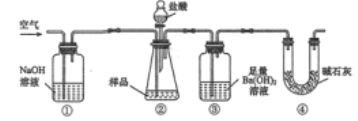
题目内容
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为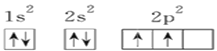
D. Z元素具有两性
【答案】B
【解析】X元素原子的4p轨道上有3个未成对电子,即X为As,Y元素的原子最外层2p轨道上有2个未成对电子,Y可能为C,Y也可能是O,X和Y可形成化合物是X2Y3,则Y为O,Z元素可以形成负一价离子,且三种元素的原子序数为42,则Z为H,A、X为As,基态As原子核外电子排布式为[Ar]3d104s24p3,故A错误;B、As位于第四周期VA族,故B正确;C、Y为氧元素,电子排布图为![]() ,故C错误;D、Z为H,不具有两性,故D错误。
,故C错误;D、Z为H,不具有两性,故D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目