题目内容
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
| | | R | |
| T | Q | | W |
A.最简单气态氢化物的热稳定性:R>Q
B.原子半径:T>Q>R
C.含T的盐溶液一定显酸性
D.最高价氧化物对应水化物的酸性:Q<W
C
解析试题分析:读图可知,T是位于第三周期第IIIA族的铝元素,Q、R、W分别为硅、氮、硫元素。由元素周期律可知,非金属性:R>Q,则最简单气态氢化物的稳定性:R>Q,故A正确;同周期主族元素的原子半径随原子序数增大而减小,故B正确;含铝元素的盐有两种:铝盐、偏铝酸盐,如属于强酸弱碱盐的AlCl3、属于强碱弱酸盐的NaAlO2,前者的溶液呈弱酸性,后者的溶液呈弱碱性,故C错误;由元素周期律可知,非金属性:Q<W,则最高价氧化物对应水化物的酸性:Q<W,故D正确。
考点:考查元素周期表和元素周期律,涉及非金属性、原子半径、气态氢化物稳定性、最高价氧化物对应水化物酸性、盐类水解等。

练习册系列答案
相关题目
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素且X常见化合价+1和—1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述正确的是
A.原子半径的大小顺序: |
| B.元素Y的简单气态氢化物的热稳定性比W的弱 |
| C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH﹤Ba(OH)2 |
X、Y、Z为短周期非金属元素,其相关性质如下:
| 元素 | X | Y | Z |
| 与H2反应条件 | 暗处反应 | 光照 | 高温、催化剂 |
| 常温下氢化物水溶液的pH | 小于7 | 小于7 | 大于7 |
A.非金属性X<Y
B.Z为第VA族元素
C.最外层电子数Z>Y
D.Y、Z的氢化物反应形成离子化合物
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是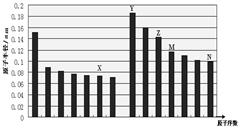
| A.最高价含氧酸的酸性:M>N |
| B.离子半径:X<Y |
| C.X和Y形成的化合物中一定含有含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是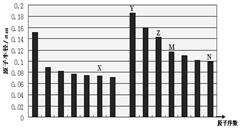
| A.非金属性:X>N |
| B.气态氢化物的稳定性:M<N |
| C.X和Y形成的化合物中只可能含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
同主族常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为HXO4<HYO4<HZO4,下列判断不正确的是
| A.单质氧化性:Y>Z | B.离子半径:X->Y- |
| C.气态氢化物稳定性:HX<HZ | D.Y单质可以在海水中提取 |
下列离子中,与Na+含有相同电子数的是
| A.F- | B.Cl- | C.Br- | D.I- |
