题目内容
【题目】下列实验操作得到的现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
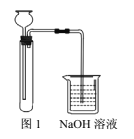
A | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液 | 溶液褪色 | BaCl2溶液显酸性 |
B | 向25mL沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 生成红褐色沉淀 | 制得Fe(OH)3胶体 |
C | 向H2S溶液中滴加CuSO4溶液 | 生成蓝色沉淀 | H2S酸性比H2SO4强 |
D | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在I2和I- |
A.AB.BC.CD.D
【答案】D
【解析】
A、滴有酚酞的Na2CO3溶液呈红色是因为碳酸根离子水解溶液显碱性:CO32-+H2O![]() HCO3-+OH-,加入氯化钡,碳酸根离子和钡离子结合水解平衡逆向进行,氢氧根离子浓度减小,碱性减弱红色褪去,故A错误;
HCO3-+OH-,加入氯化钡,碳酸根离子和钡离子结合水解平衡逆向进行,氢氧根离子浓度减小,碱性减弱红色褪去,故A错误;
B、FeCl3饱和溶液在沸水中水解生成氢氧化铁胶体,为防止胶体聚沉,当溶液呈红褐色时停止加热,故B错误;
C、向H2S溶液中滴加CuSO4溶液生成CuS沉淀和硫酸,CuS为黑色沉淀,H2S酸性比H2SO4弱,故C错误;
D、向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-,即KI3溶液中存在平衡为I3-![]() I2+I-,故D正确;
I2+I-,故D正确;
故选D。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】一定温度时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应:
,发生反应:![]() 。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列说法正确的是
A.反应在前2s的平均速率![]()
B.保持其他条件不变,体积压缩到![]() ,平衡常数将增大
,平衡常数将增大
C.相同温度下,起始时向容器中充入![]() ,达到平衡时,
,达到平衡时,![]() 的转化率大于
的转化率大于![]()
D.保持温度不变,向该容器中再充入![]() 、
、![]() ,反应达到新平衡时
,反应达到新平衡时![]() 增大
增大
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%