��Ŀ����
����Ŀ��ij��ѧʵ��С����̽���Ľ�Fe(OH)2����ȡ������
����1��
��ʵ��ҩƷ��FeS���塢ϡ������Һ��NaHCO3��Һ��
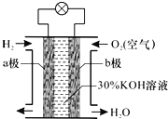
��ʵ��װ����ͼ1��
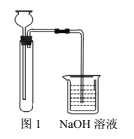
����2��
��ȡһֻ�Թܣ������м���һ��NaOH���壬�ټ���Լ2mL���Ƶ�FeSO4��Һ��
�ڽ��Թ����ھƾ��ƻ����ϣ�������NaOH�����IJ�λС�ļ���(����ʹҺ����ҷ���)��ʹ�������������������࣬�۲��²�������ɫ��
����3��
�������Թ��е���2~3 mLҺ��ʯ����
���ý�ͷ�ι�С�����Թܵײ�ע��4~5 mL���Ƶ�FeSO4��Һ��
�������Թ���Ͷ��1���̶���С�Ľ����ƣ��۲췴Ӧ����
�ش��������⣺
(1)������1���У�������Թ��е�Һ����______��NaOH��Һ��������_______��
(2)������2���У�������NaOH�����IJ�λС�ļ��ȵ�Ŀ����________��
(3)������2���ij����У��ϲ��������ɫ��________���²��������ɫ��________�������������ԭ����________��
(4)������3���з�Ӧ�Ļ�ѧ��Ӧ����ʽΪ________��
(5)������3����ʵ������м���Եij��ְ�ɫ��������ԭ����_________��
���𰸡�NaHCO3��Һ ����H2S���壬��ֹ��Ⱦ���� ���ȿ��ƻ�NaOH�������Fe(OH)2�����İ�����ʹ��Ӧ�������� ����ɫ ��ɫ �ϲ��������ˮ���ܽ��O2ת��Ϊ����ɫ�Ľ�״��ﵽ�����²��ɫFe(OH)2������Ŀ�� 2Na+2H2O+FeSO4=Fe(OH)2��+Na2SO4+H2�� ��������Һ��ʯ���������³���һ����FeSO4��Һ�Ӵ����ͷų��������ݣ����Ѹ���ϸ���������Һ����ʯ���㣬������������������Һ����ԽӴ�
��������
(1)����FeS�����ᷴӦ����Fe2+��Ȼ������Һ�м���NaHCO3��Һ���������ֽⷴӦ����Fe(OH)2������CO2���壻NaOH�Ǽ�ܹ����������巢����Ӧ��
(2)(3)FeSO4��NaOH�������ֽⷴӦ����Fe(OH)2���������嵼���Բ�����¶ȿ��ƻ������㣻Fe(OH)2���ױ�O2��������Fe(OH)3���������ʳɷַ������ж�ʵ������
(4)(5)Һ��ʯ�����Ը���������Na����Һ�е�ˮ��Ӧ����NaOH��NaOH��FeSO4��Ӧ����Fe(OH)2��ɫ������
(1)��FeS�����Թ��У�ͨ����Һ©�������м������ϡ���ᷢ����Ӧ��FeS+H2SO4=FeSO4+H2S��������Һ�й��弸����Ӧ��ȫʱ�������м���NaHCO3��Һ����������ᷴӦ��2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2����������NaHCO3��Һ����Һ��Fe2+��Ӧ����Fe(OH)2������CO2���壬CO2������Է�ֹ�����е�O2���뵽��Ӧװ�ã����Խϳ�ʱ��۲쵽Fe(OH)2��ɫ������NaOH��Һ������������H2S���壬��ֹ��Ⱦ������
(2) ������2���У�������NaOH�����IJ�λС�ļ��ȵ�Ŀ���ǿ��ƻ�NaOH�������Fe(OH)2�����İ�����ʹ��Ӧ�������У�
(3)����ʱNaOH��������������Һ�е�FeSO4��Һ������Ӧ��FeSO4+2NaOH=Na2SO4+Fe(OH)2���������ϲ�Һ���к����ܽ������е�O2���ֻᷢ����Ӧ��4Fe(OH)2+O2+2H2O=4Fe(OH)3����˻ῴ���ϲ�����ɰ�ɫ��Ϊ����ɫ���²����Ϊ��ɫ�������������ԭ�����ϲ��������ˮ���ܽ��O2ת��Ϊ����ɫ�Ľ�״��ﵽ�����²��ɫFe(OH)2������Ŀ�ģ�
(4) ������3����Na����Һ�е�H2O��Ӧ����NaOH��H2��NaOH����Һ�е�����FeSO4�������ֽⷴӦ����Fe(OH)2��ɫ������Na2SO4����Ӧ���ܻ�ѧ��Ӧ����ʽΪ2Na+2H2O+FeSO4=Fe(OH)2��+Na2SO4+H2����
(5) ������3����ʵ������м���Եij��ְ�ɫ��������ԭ���ǽ�������Һ��ʯ���������³���һ����FeSO4��Һ�Ӵ����ͷų��������ݣ����Ѹ���ϸ���������Һ����ʯ���㣬������������������Һ����ԽӴ���

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�����Ŀ������ʵ������õ�������ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ���� | ���� |
A | �ڵ��з�̪��Na2CO3��Һ�У�����BaCl2��Һ | ��Һ��ɫ | BaCl2��Һ������ |
B | ��25mL��ˮ�еμ�5��6��FeCl3������Һ��������� | ���ɺ��ɫ���� | �Ƶ�Fe(OH)3���� |
C | ��H2S��Һ�еμ�CuSO4��Һ | ������ɫ���� | H2S���Ա�H2SO4ǿ |
D | ����֧ʢ��KI3��Һ���Թ��У��ֱ�μӵ�����Һ��AgNO3��Һ | ǰ����Һ�����������л�ɫ���� | KI3��Һ�д���I2��I- |
A.AB.BC.CD.D