题目内容
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)E 的名称为____,B物质的结构简式:______;
(2)上述③~⑥转化反应中,属于取代反应的有______(用反应序号填写);
(3)写出反应⑦的反应方程式:______;
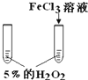
(4)如图为实验室制取E的装置图,图中a试剂为_______;

(5)某同学在试管b中加入6.0克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管b回收到3.0克乙酸,则该同学在本次实验中制得乙酸乙酯的最大质量为_______。
【答案】乙酸乙酯 CH3CH2OH ⑥ ![]() 饱和碳酸钠溶液 4.4g
饱和碳酸钠溶液 4.4g
【解析】
由图可知,①、②为甲烷在催化剂及无氧条件下,一步高效生产乙烯、苯的过程,则A为乙烯;③为乙烯与水的加成反应生成乙醇的过程,④为乙醇的催化氧化生成乙醛的过程,⑤为乙醛氧化生成乙酸的过程,⑥为乙醇与乙酸发生酯化反应生成乙酸乙酯的过程;⑦为苯与液溴发生取代反应生成溴苯和HBr的过程,以此来解答。
(1)E为乙酸乙酯;B为乙醇,其结构简式为CH3CH2OH;
(2)⑥为乙醇与乙酸发生酯化反应生成乙酸乙酯的过程,属于取代反应,故答案为:
(3)反应⑦⑦为苯与液溴发生取代反应生成溴苯和HBr的过程,其化学方程式为:![]() ;
;
(4)如图为实验室制取E的装置图,图中a为饱和碳酸钠,可以吸收乙醇,中和乙酸,降低乙酸乙酯在水中的溶解度;
(5)在试管b中加入6.0克乙酸,回收到3.0克乙酸,则参加反应的乙酸的质量为3.0g,其物质的量为![]() =0.05 mol,根据乙酸和乙醇制备乙酸乙酯的化学方程式 可知,制得的乙酸乙酯的最大的物质的量为0.05mol,其质量为0.05mol×88g/mol=4.4g。
=0.05 mol,根据乙酸和乙醇制备乙酸乙酯的化学方程式 可知,制得的乙酸乙酯的最大的物质的量为0.05mol,其质量为0.05mol×88g/mol=4.4g。

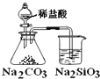
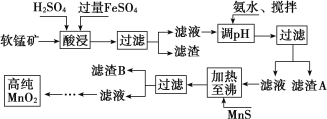
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
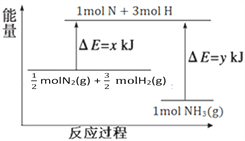
【题目】在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)![]() C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
(1)随着温度的升高,该反应的化学平衡常数减小,则ΔH__________(填“>”“<”或“=”)0,反应从起始到20 min内C的平均反应速率是________。
(2)该温度下,上述反应的化学平衡常数为________。平衡时体系内气体的总压强是反应起始时总压强的________。
(3)下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A.反应速率:vA(正)+vB(正)=vC(逆)
B.A的质量不再改变
C.B的转化率不再改变
D.密度不再改变
(4)若反应C(g)![]() A(g)+B(g) ΔH>0,进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与体系的温度、压强、X的物质的量的关系如图1、图2所示。
A(g)+B(g) ΔH>0,进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与体系的温度、压强、X的物质的量的关系如图1、图2所示。


①由图1可知,T1________(填“>”“<”或“=”)T2。
②由图2可知,当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是________________。