题目内容
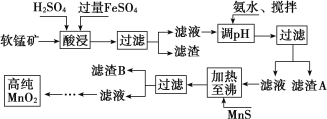
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
【答案】4H++2Fe2++MnO2=2Fe3++Mn2++2H2O 充分氧化 Fe2+ 4.3 CuS、ZnS Mn2++2H2O-2e-=4H++MnO2 94.5
【解析】
(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)加入氨水搅拌加快反应速率,生成的氢氧化亚铁充分氧化,加入氨水需调节pH至少达到4.3,恰好能使Fe3+、Al3+沉淀完全;
(3)根据工艺流程及硫化物的Ksp判断;
(4)阳极发生氧化反应,锰由+2价变成+4价;样品中二氧化锰与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中10.00mL,恰好与25.00mL 0.0800molL-1Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),则得到:MnO2~I2~2S2O32-,据此分析计算。
软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为4.3,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰。
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,化学方程式为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,离子方程式为:4H++2Fe2++MnO2=2Fe3++Mn2++2H2O,故答案为:4H++2Fe2++MnO2=2Fe3++Mn2++2H2O。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;根据题中数据可知,当Fe3+恰好沉淀完全时,c(OH-)=(Ksp(Fe(OH)3)/c(Fe3+))1/3=(10-38/10-5)=10-11mol/L,则c(H+)=10-3mol/L,溶液的pH=3;当Al3+恰好沉淀完全时,c(OH-)=(Ksp(Al(OH)3)/c(Al3+))1/3=(10-34/10-5)=101/3×10-10mol/L,则c(H+)=101/3×10-4mol/L,溶液的pH=-lg(101/3×10-4)=4+1/3≈4.3,加入氨水需调节pH至少达到4.3,恰好能使Fe3+、Al3+沉淀完全,
故答案为:充分氧化过量的Fe2+;4.3。
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,滤渣B的成分是CuS、ZnS,
故答案为:CuS、ZnS。
(4)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+;
准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液,取其中10.00mL,恰好与25.00mL0.0800molL-1Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),
则得到:MnO2~I2~2S2O32-,
1 2
n 0.02500L×0.0800molL-1×100mL/l0mL
解得:n=0.01mol
计算可得该样品MnO2纯度=0.01mol×87g/mol/0.9200g×100%=94.5%。
故答案为:Mn2+-2e-+2H2O═MnO2+4H+,94.5%。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案