题目内容
【题目】已知有如图所示转化关系(反应条件略)。已知:①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
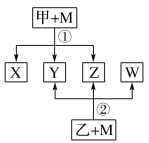
(1)Z是(写化学式):_____________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有______性。利用这种性质可以进行________项(填字母)实验操作。
A 钝化铁片 B 检验Ba2+ C 干燥氯气
(3)溴蒸气也是红棕色气体,可用来鉴别溴蒸气和X的是_________
A 湿润的淀粉碘化钾试纸 B 硝酸银溶液
C 湿润的pH试纸 D NaOH 溶液
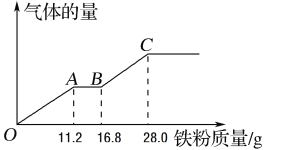
(4)现有甲和乙的稀溶液的混合溶液400 mL,将其平均分成两份。向其中一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示。OA段产生的气体是___________。如果向另外一份中逐渐加入铜粉,最多能溶解________g铜粉。
【答案】H2O 吸水 C B NO 19.2
【解析】
X是红棕色气体,即X为NO2,Y能使澄清石灰水变浑浊,但不能使品红溶液褪色,即Y是CO2,甲与M反应生成NO2和CO2,这是碳和浓硝酸的反应,即甲为浓硝酸,M为碳,浓硫酸具有吸收性,露置在空气中一段时间,吸收空气中水蒸气,质量增大,浓度降低,即乙为浓硫酸,然后进行分析;
X是红棕色气体,即X为NO2,Y能使澄清石灰水变浑浊,但不能使品红溶液褪色,即Y是CO2,甲与M反应生成NO2和CO2,这是碳和浓硝酸的反应,即甲为浓硝酸,M为碳,浓硫酸具有吸收性,露置在空气中一段时间,吸收空气中水蒸气,质量增大,浓度降低,即乙为浓硫酸,
(1)碳与浓硝酸反应C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,碳和浓硫酸反应C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O,即Z为H2O;
(2)根据上述分析,利用浓硫酸的吸水性,A、钝化铁片,利用浓硫酸的氧化性,故A不符合题意;
B、利用SO42-检验Ba2+,故B不符合题意;
C、干燥氯气,利用浓硫酸的吸水性,故C符合题意;
(3)X为NO2,与水反应:3NO2+H2O=2HNO3+NO,
A、Br2和HNO3都具有强氧化性,将I-氧化成I2,试纸变蓝,故A不符合题意;
B、Br2蒸气溶于水,形成Br-,能与AgNO3溶液反应,生成AgBr淡黄色沉淀,NO2通入AgNO3溶液中无现象,故B符合题意;
C、溴蒸气溶于水形成HBr和HBrO,NO2溶于水形成HNO3,HBr和HNO3都是强酸,因此无法鉴别,故C不符合题意;
D、都能与NaOH溶液发生反应,产生的溶液均为无色,不能鉴别,故D不符合题意;
(4)铁粉都能与稀硝酸和稀硫酸反应,HNO3的氧化性强于稀硫酸,结合图中所给信息看,反应过程应是Fe+4H++NO3-=Fe3++NO↑+2H2O,Fe+2Fe3+=2Fe2+,Fe+2H+=Fe2++H2↑,NO3-全部被还原, OA段产生的气体是NO,根据离子方程式,求出n(HNO3)= n(Fe)= 11.2g/56g·mol-1=0.2mol,BC段得出溶液中最后的溶质为FeSO4,n(H2SO4)=n(Fe)=28.0g/56g·mol-1=0.5mol,铜与混酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,n(H+)=(0.2mol+0.5mol×2)=1.2mol,n(NO3-)=0.2mol,根据离子方程式,得H+过量,出NO3-不足,即最多消耗铜的物质的量为3×0.2mol/2=0.3mol,即最多消耗Cu的质量为0.3mol×64g·mol-1=19.2g。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案