题目内容
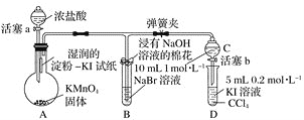
【题目】在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题;

(1)实验开始时,仪器A中盛放电石,B中应装_________,其作用是___________________。
(2)仪器D中盛放水,其作用是_________________________________________________。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称____________________。将HgO加放F中的操作方法是__________________________________。
(4)装置图中,加热F的方法叫___________,所选用温度计G的量程表示正确的是______。(填代号)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃
D.50℃~100℃ E. 0℃~360℃
(5)检验乙醛已制出的操作及现象______________________________________________。
【答案】NaOH溶液 除去由A装置导出的气流中混有的H2S 吸收乙醛蒸汽 氧化汞→水→浓硫酸 将蒸馏烧瓶横放,用药匙或纸槽将粉末送至底部,再慢慢竖立即可 水浴加热 B 取D中少量溶液,加入新制氢氧化铜悬浊液,加热,若产生红色沉淀即可证明乙醛已生成
【解析】
电石与水反应生成乙炔,在HgSO4催化作用下乙炔水化生成乙醛。为防止HgSO4催化剂中毒,应除去乙炔中的H2S杂质。检验产物乙醛可用银氨溶液或新制氢氧化铜悬浊液。
(1)实验时,蒸馏烧瓶A中盛放电石,分液漏斗中盛放饱和食盐水。打开分液漏斗活塞时,电石中主要成分CaC2与水反应生成C2H2,杂质CaS等与水生成H2S等。为防止H2S使F中HgSO4催化剂中毒,B中应装NaOH溶液,以吸收C2H2气流中混有的H2S杂质。
(2)蒸馏烧瓶F中,反应温度75℃左右,乙炔水化生成的乙醛呈气态进入仪器D中,D中盛放水,可吸收乙醛蒸汽。
(3)蒸馏烧瓶F中应盛放HgSO4溶液,可由HgO、浓硫酸、水混合生成。据“先固后液”原则,应先加入HgO;浓硫酸与水混合时,应将浓硫酸慢慢加入水中。故加入的先后顺序为氧化汞→水→浓硫酸。将HgO粉末加入F中,操作是将蒸馏烧瓶横放,用药匙或纸槽将粉末送至底部,再慢慢竖立即可。
(4)装置图中,蒸馏烧瓶F浸在烧杯内水中加热,即水浴加热。室温约25℃,F中反应温度75℃左右,故温度计G的量程0℃~100℃较为合适(选B)。
(5)证明乙醛已经生成,可以检验醛基。具体操作及现象是取D中少量溶液,加入新制氢氧化铜悬浊液,加热,若产生红色沉淀即可证明乙醛已生成。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案