题目内容
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水合硫酸铜可用作杀菌剂等。
(1)基态Cu2+的核外电子排布式为____________。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
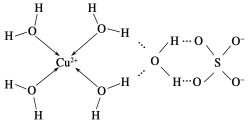
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42-的立体构型名称为________,H2O的VSEPR模型名称为____。
(3)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________。
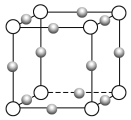
(4)Cu3N形成的晶体结构如下图所示,N3-的配位数是______。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为______________(用含a、b的式子表示)。
【答案】[Ar]3d9 [Cu(H2O)4]SO4·H2O 正四面体形 正四面体形 F的电负性比N大,N—F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子 6 ![]()
![]()
【解析】
(1)Cu元素是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子;
②根据价层电子对互斥理论确定离子空间构型及原子杂化方式;
(3)NF3中N﹣F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(4)该晶胞中小球个数=12×![]() =3,白色球个数=8×
=3,白色球个数=8×![]() =1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=
=1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=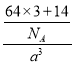 ,据此计算NA。
,据此计算NA。
(1)Cu元素是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理知铜离子核外电子排布式为[Ar]3d9;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子,则胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O;
②胆矾中SO42﹣的价层电子对个数=4+1/2×(6+2﹣4×2)=4,所以其空间构型正四面体结构;H2O中O原子价层电子对个数=2+1/2×(6﹣2×1)=4,所以H2O的VSEPR模型为四面体;
(3)F的电负性大于N元素,NF3中N﹣F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子;
(4)该晶胞中小球个数=12×![]() =3,白色球个数=8×
=3,白色球个数=8×![]() =1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=
=1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=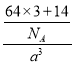 ,则NA=
,则NA=![]() 。
。

【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的价电子排布式为nsnnpn |
Y | Y的负一价离子的电子层结构都与氩相同 |
Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
W | W原子共有6个价电子,其中五个价电子位于第三能层d轨道 |
(1)Z在元素周期表中的位置 _______________________,Z的氢化物空间构型是________
(2)在H—Y、H—Z两种共价键中,键的极性较强的是____________(用相应的元素符号表示该共价键)。
(3)XZ2分子中X以________方式杂化。
(4)写出W元素的原子核外电子排布式___________________________________。
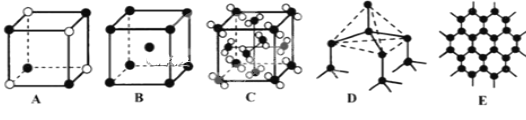
(5)Y元素和Na形成晶体的部分结构可用下图中的_________来表示(填序号)。