题目内容
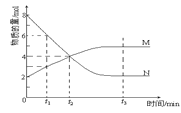
【题目】在某一恒温体积可变的密闭容器中发生反应:A(g)+B(g)![]() 2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
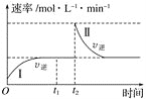
A.O~t2时,v正>v逆
B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ
C.t2时刻改变的条件是向密闭容器中加C
D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
【答案】C
【解析】
A.0~t1,反应正向进行,说明v正>v逆,t1~t2,反应到达平衡,v正=v逆,t2时,反应逆向进行,v逆>v正,A错误;
B. 0~t1,反应正向进行,说明v正>v逆,t1~t2,反应到达平衡,v正=v逆,t2时,反应逆向进行,v逆>v正,因此达到平衡时A的体积分数Ⅰ<Ⅱ,B错误;
C.向密闭容器中加C,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同,符合图象,C正确;
D.该反应是在恒温下进行,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以Ⅰ、Ⅱ两过程达到平衡时,平衡常数KI=KⅡ,D错误;
故合理选项是C。

【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为___________。
(2)制取氢氧化铜的化学方程式为______________________。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ. ______________________。
(进行实验)
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:____________________ |
②过滤、洗涤、干燥。 | 得红色固体 |
【题目】乙苯(![]() )、苯乙烯(
)、苯乙烯(![]() )均是重要的有机溶剂和工业原料。
)均是重要的有机溶剂和工业原料。
已知:①![]() (g)+HCl(g)
(g)+HCl(g)![]()
![]() (g) △H1= 54 kJmol1
(g) △H1= 54 kJmol1
②H2(g)+Cl2(g)=2HCl(g) △H2=185 kJmol1
③![]() (g)+Cl2(g)
(g)+Cl2(g)![]()
![]() (g)+HCl(g) △H3=118kJmol1
(g)+HCl(g) △H3=118kJmol1
④相关化学键的键能数据如表所示:
化学键 | CH | CC | C=C | CCl | HCl |
键能/(kJmol1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)x=___;
(2)![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H4
(g) △H4
①△H4=___。
②上述反应中,![]() 的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
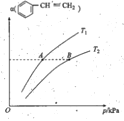
I.A、B两点的平衡常数:K(A)___K(B)(填“大于”、“小于”或“等于”)。
II.A、B两点的正反应速率:v(A)___v(B)(填“大于”、“小于”或“等于”)。
(3)工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)。向体积为VL的恒容容器中充入amol乙苯,压强为1×106Pa,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①乙苯的平衡转化率为___;
②此温度下乙苯催化脱氢的方法制取苯乙烯的平衡常数Kp=___Pa;
③实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示。[M=n(H2O)/n(乙苯]
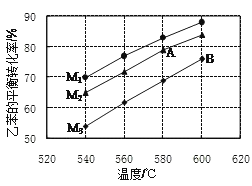
a.图中投料比(M1、M2、M3)的大小顺序为___;
b.随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示)。