题目内容
【题目】(1)写出下列盐溶液蒸干所得的产物:
①加热蒸干Al2(SO4)3溶液,得到的固体物质是_______________(写化学式)。
②NaHCO3溶液蒸干灼烧得到的固体物质是_________________(写化学式)。
③加热蒸干Na2SO3溶液,得到的固体物质是_________________(写化学式)。
④FeCl2溶液蒸干灼烧得到的固体物质是__________________(写化学式)。
(2)元素铬(Cr)在溶液中以多种形式存在,其中Cr2O72-(橙红色)、CrO42-(黄色)在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
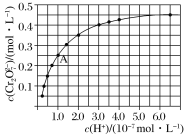
①用离子方程式表示Na2CrO4溶液中的转化反应:_________________________________。
②由图可知,溶液酸性增大,CrO42-的平衡转化率___________(填“增大”“减小”或“不变”);根据A点数据,计算出该转化反应的平衡常数为___________。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
【答案】Al2(SO4)3 Na2CO3 Na2SO4 Fe2O3 2CrO42-+2H+![]() Cr2O72-+H2O 增大 1.0×1014 小于
Cr2O72-+H2O 增大 1.0×1014 小于
【解析】
(1)不同溶液的蒸干,具有一定规律:1、强碱强酸盐不水解,加热蒸发其水溶液得其固体;2、弱碱与易挥发性酸形成的盐,水解生成易挥发性酸,加热蒸发其水溶液有碱生成;若碱难溶解,则生成沉淀;若碱易挥发,则逸出气体;3、弱碱与难挥发性酸生成的盐,水解生成难挥发性酸,若碱不挥发,则加热蒸发其水溶液得其盐的晶体;4、多元弱酸的正盐,不论弱酸是不是易挥发,蒸干其水溶液,都得到原来的溶质,只要阳离子水解,产物不易挥发;5、易挥发性弱酸的酸式盐,加热蒸干得其正盐,只要阳离子水解产物不挥发;6、易被氧化的盐,加热蒸干过程中,盐被O2氧化,以此分析。
(2)①图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;A点Cr2O72-的浓度为0.25mol/L,根据Cr元素守恒可知CrO42-的浓度为0.5mol/L,H+浓度为1×10-7mol/L;
此时该转化反应的平衡常数为K=![]() ;
;
②溶液酸性增大,平衡2CrO42-+2H+![]() Cr2O72-+H2O 正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,计算反应的平衡常数;
Cr2O72-+H2O 正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,计算反应的平衡常数;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,升高温度平衡向吸热方向移动,据此判断。
(1)①Al2(SO4)3中的铝离子可以水解,但是Al3+水解生成氢氧化铝和硫酸,生成的酸是硫酸,由于硫酸是高沸点酸,不能挥发,最后氢氧化铝和硫酸接着反应,仍然会留下Al2(SO4)3;
②碳酸氢钠在溶液中受热分解生成碳酸钠、水和二氧化碳,所以最后得到的固体物质是Na2CO3;
③亚硫酸钠在蒸干的过程中不断被空气氧化而变成硫酸钠,所以最后得到的固体物质是Na2SO4;
④Fe2+水解生成Fe(OH)2和HCl,在加热蒸干过程中HCl挥发,Fe(OH)2逐渐被氧化生成Fe(OH)3,Fe(OH)3灼烧分解生成Fe2O3。
故本题答案为:Al2(SO4)3 ;Na2CO3 ;Na2SO4 ;Fe2O3;
(2)①由图象可知,随着H+浓度增大,Cr2O72-浓度增大,则离子反应方程式为2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
②溶液酸性增大,平衡正向进行,CrO42-的平衡转化率增大,A点Cr2O72-的浓度为0.25mol/L,根据Cr元素守恒可知CrO42-的浓度为0.5mol/L,H+浓度为1×10-7mol/L;
此时该转化反应的平衡常数为K=![]() =
=![]() =1.0×1014;
=1.0×1014;
故答案为:增大;1.0×1014 ;
③升高温度,CrO42-的平衡转化率减小,平衡逆向移动,说明正方向是放热反应,则ΔH<0;
故答案为:小于。

【题目】下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用蒸馏水润湿的pH试纸测溶液pH | 一定会使测定结果偏低 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握______________的活塞,右手摇动___________,眼睛注视________________,直到加入最后一滴盐酸时,溶液由______色变为______色,并_____________________为止。
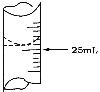
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为____________。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000 mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数

