题目内容
【题目】短周期主族元素R、X、Y和Z的原子序数依次增大,RZ3溶于水生成一种具有漂白性的物质,生成的另一种物质的分子模型如图A所示。X和Y的单质按一定比例混合后恰好能完全溶于足量水中,在其水溶液中缓慢通入CO2气体,沉淀质量(m)与CO2的体积(V)的关系如图B所示。

下列说法一定正确的是( )
A. Y一定位于第三周期第ⅢA族B. 原子半径:X>Y>Z
C. Z与X、Y均形成离子化合物D. R和Z的氧化物对应的水化物都是强电解质
【答案】B
【解析】
依题意,图A表示氨分子,漂白性物质是次氯酸,所以R为氮元素,Z为氯元素。X和Y的单质组成混合物能恰好溶于水中,由图B知,产生的沉淀能与CO2反应,则X为钠元素,Y可能为硅元素或铝元素。
A、若Y为硅元素,则位于第三周期第ⅣA族,故A项错误;
B、同周期元素从左到右半径减小,原子半径:Na>Si(Al)>Cl,故B项正确;
C、硅与氯形成的化合物SiCl4是共价化合物,故C项错误;
D、HNO2、HClO都是弱酸,是弱电解质,故D项错误。
答案选B。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
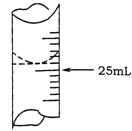
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数






