题目内容
20.将CuCl2•xH2O的晶体20.52g溶于水,配成100mL溶液,取此溶液25mL,与102g质量分数为10%的AgNO3溶液作用,刚好把溶液中的Cl-沉淀完全.求:(1)反应生成的AgCl沉淀的物质的量;
(2)所配CuCl2溶液的物质的量浓度;
(3)CuCl2•xH2O中的x值.
分析 根据n=$\frac{m}{M}$计算硝酸银的物质的量,根据Ag元素守恒计算AgCl的物质的量;根据CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2计算25ml溶液中CuCl2的物质的量,进而计算100mL溶液中CuCl2的物质的量,CuCl2的物质的量等于CuCl2•xH2O的物质的量,再根据M=$\frac{m}{n}$计算CuCl2•xH2O的摩尔质量,进而计算出x的值.
解答 解:(1)102g质量分数为10%的AgNO3溶液中硝酸银的质量为102g×10%=10.2g,
则n(AgNO3)=$\frac{10.2g}{170g/mol}$=0.06mol,由Ag元素守恒得AgCl的物质的量为n(AgCl)=0.06mol;
答:反应生成的AgCl沉淀的物质的量为0.06mol;
(2)由CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2可知25ml溶液中CuCl2的物质的量为n(CuCl2)=$\frac{1}{2}$n(AgNO3)=0.03mol,
故100mL溶液中CuCl2的物质的量为0.03mol×$\frac{100mL}{25mL}$=0.12mol,
则其物质的量浓度为c(CuCl2)=$\frac{0.12mol}{0.1L}$=1.2mol/L;
答:所配CuCl2溶液的物质的量浓度为1.2mol/L;
(3)CuCl2•xH2O的摩尔质量=$\frac{20.52g}{0.12}$=171 g/mol,则CuCl2•xH2O的相对分子质量为171,则171=18x+64+71,所以x=2,
答:CuCl2•xH2O中的x值为2.
点评 本题考查了物质的量的有关计算、化学方程式有关计算,难度不大,明确发生的反应即可解答,注意理解化学方程式表示的意义.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 质子数与中子数之差为50 | |
| D. | 89Y和90Y是两种不同的核素 |
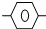 CH2-CH=CHCH3的说法正确的是( )
CH2-CH=CHCH3的说法正确的是( )| A. | 所有C原子可能共平面 | B. | 除苯环外的C原子共直线 | ||
| C. | 最多只有10个C共平面 | D. | 最多只有4个C共直线 |
| A. | 单质的氧化性 | B. | 得电子能力 | C. | 氢化物的稳定性 | D. | 原子半径 |
| A. | c(Ag+)•c(Cl-)增大 | B. | c(Ag+)•c(Cl-)不变 | C. | c(Ag+)、c(Cl-)均不变 | D. | c(Ag+)、c(Cl-)均减小 |
