题目内容
4.下列有关说法中,错误的是( )| A. | 浓硫酸置于敞口容器中,溶液质量会增加 | |
| B. | 处理散落在地面上的汞的方法是撒上硫粉 | |
| C. | 干燥氨气既可用碱性干燥剂,碱石灰,也可用中性干燥剂,如:无水氯化钙 | |
| D. | 常温下,Fe与浓硫酸,不可能有氢气生成 |
分析 A.浓硫酸具有吸水性;
B.Hg有毒,与S反应转化为无毒物质;
C.氨气与氯化钙结合生成络合物;
D.常温下,Fe与浓硫酸发生钝化生成致密的氧化物阻止反应进一步发生.
解答 解:A.浓硫酸具有吸水性,则浓硫酸置于敞口容器中,溶液质量会增加,故A正确;
B.Hg有毒,与S反应转化为无毒物质,则处理散落在地面上的汞的方法是撒上硫粉,故B正确;
C.氨气与氯化钙结合生成络合物,则干燥氨气既可用碱性干燥剂,碱石灰,不能用无水氯化钙,故C错误;
D.常温下,Fe与浓硫酸发生钝化生成致密的氧化物阻止反应进一步发生,则不可能有氢气生成,故D正确;
故选C.
点评 本题考查浓硫酸的性质,为高频考点,把握浓硫酸的吸水性、强氧化性及干燥剂的选择等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
14.常温下,石灰乳悬浊液中存在如下平衡:Ca(OH)2(s)═Ca2+(aq)+2OH-(ag),下列外界条件改变,石灰乳悬浊液中pH仍保持不变的是( )(不考虑固体与水热效应)
| A. | 加热 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |
15.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中不正确的是( )
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X>Y>Z | D. | 原子序数:X>Y>Z |
12.现有三种元素的基态原子的电子排布式如下:
①3s23p4;②1s22s22p63s23p3;③1s22s22p5.则上述三种原子的第一电离能大小关系正确的是( )
①3s23p4;②1s22s22p63s23p3;③1s22s22p5.则上述三种原子的第一电离能大小关系正确的是( )
| A. | ②>①>③ | B. | ③>①>② | C. | ③>②>① | D. | ①>②>③ |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3•H2O分子数为0.1 NA | |
| B. | 0.1 mol•L-1 Na2CO3溶液中所含的Na+离子数为0.2 NA | |
| C. | 标准状况下,2.24 L的水含有的分子数为0.1NA | |
| D. | 一定条件下,3.2 g O2和O3混合气体中含有的O原子数目为0.2 NA |
9.能发生消去反应,且生成物中存在同分异构体的是( )
| A. | 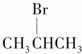 | B. | 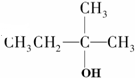 | C. | 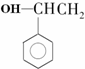 | D. | CH3Cl |
16.几种短周期元素的原子半径及主要化合价见下表
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>X>Y | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物的水化物的碱性:X>R>Y | |
| D. | 单质与氢气化合的难易程度:Z>T |
14.下列实验一般需要水浴加热的是( )
| A. | 银镜反应 | B. | 制取乙酸乙酯 | C. | 乙酸乙酯水解 | D. | 乙醇的消去反应 |
 (1)BCl3的分子构型sp2.第一电离能介于B、N之间的第二周期元素有3种.写出与BCl3结构相同的一种等电子体NO3-或CO32-(写离子).
(1)BCl3的分子构型sp2.第一电离能介于B、N之间的第二周期元素有3种.写出与BCl3结构相同的一种等电子体NO3-或CO32-(写离子).