题目内容
AgCl(s)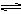 Ag+(aq) + Cl-(aq),平衡时,Ksp =C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
Ag+(aq) + Cl-(aq),平衡时,Ksp =C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
B
解析试题分析:从平衡移动的角度分析,将过量氯化银分别放入下列溶液中,依据温度不变
Ksp=c(Ag+)?c(Cl-)为定值,Cl-浓度越大,则Ag+的浓度越小;①100mL蒸馏水中,c(Cl-)=0,②24mL 0.1mol?L-1NaCl,c(Cl-)=0.1mol?L-1,③10mL 0.1mol?L-1MgCl2 中,c(Cl-)=0.2mol?L-1所以Cl-浓度:③>②>①,依据Ksp=c(Ag+)?c(Cl-)为定值,银离子浓度由大到小的顺序是:①②③,而④加入的是银离子,所以30mL 0.1mol?L-1AgNO3溶液中c(Ag+)=0.1mol?L-1,所以④中c(Ag+)最大;银离子浓度由大到小的顺序是:④①②③;选B。
考点:考查难溶电解质的溶解平衡

改变下列条件,不能使水的电离程度增大的是
| A.加热 |
| B.加入少量的盐酸 |
| C.加入少量的Na2CO3固体 |
| D.加入少量的NH4Cl晶体 |
下列叙述正确的是
| A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
D.在NaHCO3溶液中:c(OH-)+c( )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则NaHSO4溶液的pH是( )(已知 )
)
| A.2 | B.2.3 | C.2.6 | D.2.9 |
已知实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1 NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀;② 向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③ 向沉淀c中滴加0.1 mol·L-1 KI溶液,沉淀变为黄色。下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl—(aq) Ag+(aq)+Cl—(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl 转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
下述实验能达到预期目的的是
| | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等物质的量浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A.V3>V2>V1 | B.V1=V2=V3 |
| C.V3>V2=V1 | D.V1=V2>V3 |
下列各选项所述的两个量中,前者一定小于后者的是( )
| A.纯水在25 ℃和100 ℃时的pH |
| B.CH3COONa溶液中Na+和CH3COO-的浓度 |
| C.相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D.用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) |