题目内容
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) |
D
解析试题分析: A、0.1 mol/L的(NH4)2SO4溶液中NH4+水解,溶液显酸性,则溶液中离子浓度大小关系是c(NH4+)>c(SO42-)>c(H+)>c(OH-),A不正确;B、0.1 mol/L的NaHCO3溶液中根据物料守恒可知c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),B不正确;C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中含有相同浓度的HA和NaA,溶液显碱性,说明A-的水解程度大于HA的电离程度,因此根据电荷守恒可知溶液中离子浓度大小关系是c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),C不正确;D、在25℃100 mL NH4Cl溶液中根据物料守恒可知c(Cl-)=c(NH4+)+c(NH3·H2O),D正确,答案选D。
考点:考查溶液中离子浓度关系以及大小比较的判断

AgCl(s)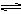 Ag+(aq) + Cl-(aq),平衡时,Ksp =C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
Ag+(aq) + Cl-(aq),平衡时,Ksp =C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
相同物质的量浓度的NaCN 和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN 和HClO说法正确的是
| A.酸根离子浓度:c(CNˉ)<c(ClOˉ) |
| B.电离程度:HCN>HClO |
| C.pH:HClO>HCN |
| D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
对水的电离平衡不产生影响的粒子是( )
| A.Fe3+ | B.Cl- | C.HCl | D.CH3COO- |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
下列溶液加热蒸干灼烧后,能得到该溶质固体的是( )
| A.Fe2(SO4)3 | B.KHCO3 | C.AlCl3 | D.NH4NO3 |
室温时,0.1mo1/L某一元酸HA在水中有1%发生电离,下列叙述不正确的是
A.该溶液的pH= 3 3 | |
B.由HA电离出的c(H+)约为水电离出的c(H+)的108倍 | C.Na2A溶液显碱性 |
D.升高温度,溶液的pH增大 |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离平衡常数,若已知下列反应可以发生:①NaCN+HNO2=HCN+NaNO2,②NaCN+HF=HCN+NaF,③NaNO2+HF=HNO2+NaF,由此可判断下列叙述不正确的是
| A.K(HF)=7.2×10-4 |
| B.K(HCN)<K(HNO2)<K(HF) |
| C.根据①③两个反应即可知三种酸的相对强弱,相同条件下HCN的酸性最弱 |
| D.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
25 ℃时,水的电离达到平衡:H2O  H++OH- ;下列叙述正确的是
H++OH- ;下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH ,平衡正向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |