题目内容
1.取一定质量的氯酸钾和二氧化锰的混合物共热制氧气,反应开始时二氧化锰在混合物中的质量百分含量为20%,当反应进行到二氧化锰在混合物中质量百分含量为25%时,求氯酸钾分解的百分率?分析 设氯酸钾和二氧化锰的混合物质量为100g,则二氧化锰的质量为100g×20%=20g,二氧化锰在反应起催化剂作用,所以质量不变,当反应进行到二氧化锰在混合物中质量百分含量为25%时,设剩余固体的质量为m,则$\frac{20g}{m}$×100%=25%,据此计算m,求出分解的氯酸钾的质量,进而计算氯酸钾分解的百分率.
解答 解:设氯酸钾和二氧化锰的混合物质量为100g,则二氧化锰的质量为100g×20%=20g,二氧化锰在反应起催化剂作用,所以质量不变,当反应进行到二氧化锰在混合物中质量百分含量为25%时,设剩余固体的质量为m,则$\frac{20g}{m}$×100%=25%,解得m=80g,根据质量守恒定律可以知道,生成氧气的质量为:100g-80g=20g;
依据方程式得:2KClO3$\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑
245 96
m(KClO3) 20g
解得m(KClO3)=51g,
氯酸钾分解的百分率$\frac{51g}{100g-20g}$×100%=63.75%;
答:氯酸钾分解的百分率为63.75%.
点评 本题考查了有关方程式计算,明确二氧化锰在反应中做催化剂,其质量不变是解题关键,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
11.下列反应能用勒沙特列原理解释的是( )
| A. | 由SO2和O2反应制SO3需使用催化剂 | |
| B. | 燃烧粉碎的黄铁矿矿石有利于三氧化硫的生成 | |
| C. | 硫酸生产中用98.3%的硫酸吸收SO3,而不用水或稀硫酸吸收SO3 | |
| D. | 用氮气和氢气合成氨需采用高压 |
12.有关表格中的分类正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 水玻璃 | 盐酸 | 硫酸 | 次氯酸 | 干冰 |
| B | 冰 | 氨水 | 碳酸钙 | 水 | 氨气 |
| C | 氯水 | 漂白粉 | 苛性钠 | 碳酸 | 氯化银 |
| D | 苏打 | 赤铁矿 | 氯化钡 | 氢硫酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
16.下列物质属于氧化物的是( )
| A. | H2,O3 | B. | H2SO3,H2CO3 | C. | SO2,NO | D. | Na2SO3,KClO3 |
6.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸钙和醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 锌和硝酸银溶液反应:Zn+Ag+═Zn2++Ag | |
| D. | 氧化铜与稀盐酸反应:CuO+H+═Cu2++H2O |
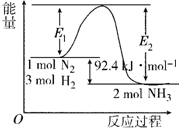 下达到平衡时H2的转化率为33.3%.该温度下的平衡常数K的值为$\frac{100}{27}$.若升高温度,K值减小(填“增大”“减小”或“不变”).
下达到平衡时H2的转化率为33.3%.该温度下的平衡常数K的值为$\frac{100}{27}$.若升高温度,K值减小(填“增大”“减小”或“不变”).