题目内容
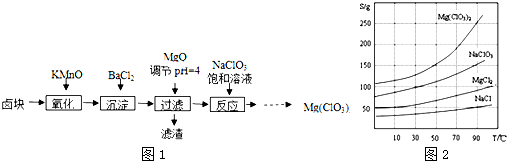
13.在500℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1.反应过程中能量变化如图所示,回答下列问题:(1)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量<(填“<”“>”或“=”)46.2kJ,理由是此反应为可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应.
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol.则该条件
 下达到平衡时H2的转化率为33.3%.该温度下的平衡常数K的值为$\frac{100}{27}$.若升高温度,K值减小(填“增大”“减小”或“不变”).
下达到平衡时H2的转化率为33.3%.该温度下的平衡常数K的值为$\frac{100}{27}$.若升高温度,K值减小(填“增大”“减小”或“不变”).
分析 (1)此反应为可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应;
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):0.15 0.45 0
变化量(mol):0.05 0.15 0.1
平衡量(mol):0.1 0.3 0.1
氢气转化率=$\frac{反应的氢气物质的量}{氢气起始物质的量}$×100%;
平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小.
解答 解:(1)由图可知,1mol N2和3mol H2完全反应放出热量为92.4kJ,此反应为可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应,充分反应后,放出的热量<46.2kJ,
故答案为:<;此反应为可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应;
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):0.15 0.45 0
变化量(mol):0.05 0.15 0.1
平衡量(mol):0.1 0.3 0.1
氢气转化率=$\frac{0.15mol}{0.45mol}$×100%=33.3%;
平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.{1}^{2}}{0.1×0.{3}^{3}}$=$\frac{100}{27}$;
正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,
故答案为:33.3%;$\frac{100}{27}$;减小.
点评 本题考查化学平衡计算、平衡常数,注意三段式在化学平衡计算中应用,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 在相同条件下,两种物质的体积之比等于其物质的量之比 | |
| B. | 同温同压下,两种气体的体积之比等于其分子个数之比 | |
| C. | 相同条件下,相同体积的氮气和一氧化碳的质量也相同 | |
| D. | 同温同压下,两种气体的体积之比一定等于其原子个数之比 |
 将0.8mol I2(g)和1.2mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)并达到平衡.HI的体积分数随时间的变化如表格所示:
将0.8mol I2(g)和1.2mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)并达到平衡.HI的体积分数随时间的变化如表格所示:| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
(2)在条件I从开始反应到到达平衡时,H2的反应速率为0.12 mol/(L•min).
(3)为达到条件II的数据,对于反应体系可能改变的操作是降低温度.
(4)该反应的△H<0(填“>“,“<“或“=“)
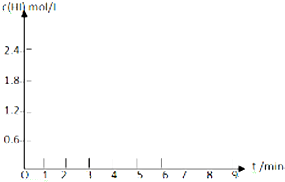
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半.请在图中画出c(HI)随时间变化的曲线.
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| A. | 硫酸的摩尔质量是98g | B. | 1mol N2的质量为28g/mol | ||
| C. | 摩尔是物质的量的单位 | D. | 1mol氧的质量等于16g |