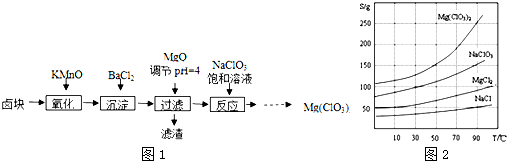
题目内容
14.下列叙述中有( )句是正确的.①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④标准状况下,5.6LSO3含有的分子数为0.25NA
⑤蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑥标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解
⑦46g NO2和N2O4的混合气体中含有的原子个数为3NA
⑧常温下,4g CH4含有NA个C-H共价键
⑨10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数为9.8%
⑩1mola2O2与水完全反应时转移电子数为2NA.
| A. | 3句 | B. | 4句 | C. | 5句 | D. | 6句 |
分析 ①蛋白质溶液为胶体;
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积的单位是L/mol;
④标准状况下,SO3为固体;
⑤蒸发操作时,当有大量固体析出,少量液体剩余时即停止加热;
⑥标准状况下,铝在浓硫酸钝化;
⑦NO2和N2O4的最简式均为NO2;
⑧求出CH4的物质的量,然后根据1mol甲烷中含4molC-H键来分析;
⑨由于硫酸浓度越大,硫酸的密度越大,则10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数大于9.8%;
⑩Na2O2与水反应时为歧化反应.
解答 解:①蛋白质溶液是胶体,胶体能产生丁达尔效应,即有光亮的通路,故正确;
②一定温度和压强下,气体摩尔体积一定,根据V=nVm知,气体体积主要由其物质的量决定,故正确;
③气体摩尔体积的单位是L/mol,体积的单位为L,故错误;
④标准状况下,SO3为固体,不能根据气体摩尔体积来计算其物质的量,故错误;
⑤蒸发操作时,当有大量固体析出,少量液体剩余时即停止加热,若停止加热过晚,会造成晶体的飞溅,故错误;
⑥标准状况下,铝在浓硫酸钝化,反应程度很小,不能完全溶解,故错误;
⑦NO2和N2O4的最简式均为NO2,故46g NO2和N2O4的混合气体中含有的NO2的物质的量为1mol,故含有的原子个数为3NA个,故正确;
⑧4gCH4的物质的量为0.25mol,而1mol甲烷中含4molC-H键,故0.25mol甲烷中含NA条C-H键,故正确;
⑨硫酸的质量分数越大,硫酸溶液的密度越大,稀释过程中硫酸的质量不变,由于稀释后硫酸的密度减小,则10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数会大于$\frac{10}{100}$×98%=9.8%,故错误;
⑩Na2O2与水反应时为歧化反应,1mol过氧化钠转移1mol电子,即NA个,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| A. | 0.01mol | B. | 0.1mol | C. | 0.02mol | D. | 0.2mol |
| A. | 1 mol氧气的质量为32 g | |
| B. | 常温常压下,1 mol CO2气体体积约为22.4 L | |
| C. | CO2的摩尔质量为44 g•mol-1 | |
| D. | 1 L 2 mol•L-1的BaCl2溶液中含Cl-的个数为2.408×1024 |
| A. | 烧菜用过的铁锅,经放置因发生氧化还原反应常出现红棕色斑迹 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量的MgSO4 | |
| C. | 蒸馏时温度计时用来测定蒸馏烧瓶中液体的温度 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
| A. | 硫酸的摩尔质量是98g | B. | 1mol N2的质量为28g/mol | ||
| C. | 摩尔是物质的量的单位 | D. | 1mol氧的质量等于16g |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | nCH2=CH2$\stackrel{一定条件}{→}$ | ||
| C. |  +HNO3$→_{加热}^{浓硫酸}$ +HNO3$→_{加热}^{浓硫酸}$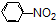 +H2O +H2O | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |