题目内容
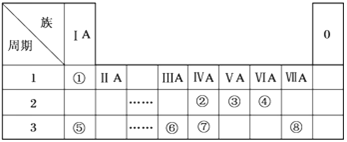
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)在此元素周期表的一部分中,金属性最强的元素是__________(填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________(填化学式)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
![]()
X溶液与Y溶液反应的离子方程式为______________,N→⑥的单质的化学方程式为______________________。
【答案】Na Na>Al HNO3>H2CO3>H2SiO3 Na+[![]() ]-或Na+[
]-或Na+[![]() ]- a、b Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融)
]- a、b Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据元素在周期表的位置可知:元素①-⑧分别为H、C、N、O、Na、Al、Si、Cl。
(1)根据同一周期元素的金属性逐渐减弱,同一主族元素的金属性逐渐增强分析;
(2)同一周期从左到右原子半径逐渐减小;
(3)根据非金属性越强,最高价含氧酸的酸性越强分析判断;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,则该化合物为H2O2;
(6)M是仅含非金属的盐,所以一定是铵盐,Z→N→⑥的单质,⑥为Al,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应。
根据元素在周期表的位置可知:元素①-⑧分别为H、C、N、O、Na、Al、Si、Cl。
(1)由于在同一周期元素的金属性逐渐减弱,同一主族元素的金属性逐渐增强。所以上述元素中Na的金属性最强;
(2)⑤、⑥分别是钠和铝,根据“同周期元素原子从左到右半径逐渐减小”,则原子半径Na>Al。
(3)②、③、⑦分别为碳、氮和硅,由于同一周期的元素的非金属性逐渐增强,同一主族的元素的非金属性逐渐减弱,元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,元素的非金属性:N>C>Si,所以酸性:HNO3>H2CO3>H2SiO3;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物可以是NaOH或者NaClO,NaOH电子式为Na+[![]() ]-,NaClO电子式为Na+[
]-,NaClO电子式为Na+[![]() ]-。
]-。
(5)表中两种元素的原子按1∶1组成的常见液态化合物为H2O2,其稀溶液分解常用的催化剂为MnO2和FeCl3,因此答案为a、b;
(6)由图可知:⑥的单质为铝,M为只含非金属元素的盐应该是铵盐,因此X和Y的反应应该是铵盐和氨水之间的反应,Z为Al(OH)3,N为Al2O3,X溶液与Y溶液反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;电解熔融的氧化铝可以制取金属Al,则N→⑥的单质的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。

【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 | NH4+、Na+、NO3-、Cl- | 一定能大量共存 NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D