题目内容
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
(1)基态钛原子的价电子排布图为_________________,金属钛晶胞如图1所示,为________________堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37 ℃,沸点为136 ℃,可知TiCl4为_______晶体。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是_________________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________________。
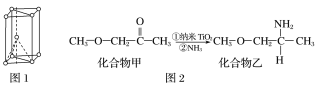
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为__________。
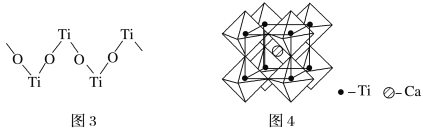
(5)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________个氧离子包围,钙钛矿晶体的化学式为________________。
【答案】![]() 六方最密 分子 化合物乙分子间形成氢键 N>O>C TiO2+(或[TiO]n2n+) 6 12 CaTiO3
六方最密 分子 化合物乙分子间形成氢键 N>O>C TiO2+(或[TiO]n2n+) 6 12 CaTiO3
【解析】
(1)Ti是22号元素,其3d、4s电子为其价电子;由金属钛晶胞结构分析钛原子的堆积方式;(2)根据TiCl4的熔、沸点分析晶体类型;(3)化合物乙含有N-H键,乙分子间可以形成氢键;化合物乙中采取sp3杂化的原子有C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道半充满为稳定结构,第一电离能大于O;(4)根据结构图,每个钛原子与2个氧原子成键、每个氧原子与2个钛原子成键,所以该离子中原子个数比为1:1;(5)根据图4,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子。
(1)Ti是22号元素,其3d、4s电子为其价电子,其价电子排布图为![]() ;由金属钛晶胞结构可知,金属钛属于六方最密堆积;(2)TiCl4的熔、沸点较低,所以TiCl4属于分子晶体;(3)化合物乙含有N-H键,乙分子间可以形成氢键而甲不能,所以化合物乙的沸点明显高于化合物甲;化合物乙中采取sp3杂化的原子有C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道半充满为稳定结构,第一电离能大于O,故第一电离能由大到小的顺序为N>O>C;(4)根据结构图,每个钛原子与2个氧原子成键、每个氧原子与2个钛原子成键,所以该离子中原子个数比为1:1,该离子的化学式为[TiO]n2n+;(5)根据图4,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊原则,晶胞在氧原子数是
;由金属钛晶胞结构可知,金属钛属于六方最密堆积;(2)TiCl4的熔、沸点较低,所以TiCl4属于分子晶体;(3)化合物乙含有N-H键,乙分子间可以形成氢键而甲不能,所以化合物乙的沸点明显高于化合物甲;化合物乙中采取sp3杂化的原子有C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道半充满为稳定结构,第一电离能大于O,故第一电离能由大到小的顺序为N>O>C;(4)根据结构图,每个钛原子与2个氧原子成键、每个氧原子与2个钛原子成键,所以该离子中原子个数比为1:1,该离子的化学式为[TiO]n2n+;(5)根据图4,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊原则,晶胞在氧原子数是![]() 、钛原子数是
、钛原子数是![]() ,1个钙离子位于立方晶胞的体心,所以钙钛矿晶体的化学式为CaTiO3。
,1个钙离子位于立方晶胞的体心,所以钙钛矿晶体的化学式为CaTiO3。