题目内容
【题目】在一定条件下发生反应:4NO2(g)+O2(g)![]() 2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
时间/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol·L-1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol·L-1) | 1.00 | c1 | c2 | 0.50 |
(1)0~10s内N2O5的平均反应速率为__ ,此温度下的平衡常数为___。
(2)其他条件不变,将容器体积压缩一半,则重新达到平衡时c(N2O5)___2.00mol·L-1(填“>、<或=”,下同)
(3)假设温度T1时平衡常数为K1,温度T2时平衡常数为K2,若K1<K2,则T1____T2。
(4)下列可以作为平衡的依据的是___
A.容器内混合气体的颜色不再改变
B.生成1molO2的同时消耗2molN2O5
C.混合气体的平均摩尔质量不再变化
D.混合气体的密度不再变化
(5)改变哪些措施可以增加NO2的平衡转化率___(答出任意两条及以上)
(6)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=___ kJ·mol1,利于该反应自发进行的条件是___(选填“高温”或“低温”)。
【答案】0.1mol·L-1·s-1 0.125 > > AC 增加O2浓度、降低温度、增大压强、及时分离N2O5 ﹣746.5kJ/mol 低温
【解析】
(1) 4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
起始(mol/L) 4 1 0
10s内转化(mol/L) 2 0.5 1
10s末(mol/L) 2 0.5 1
故用N2O5表示平均化学反应速率![]() =
=![]() =0.1mol·L-1·s-1;由10s~15s内氧气浓度不变可知,该反应在10s末已经处于平衡状态,故该反应平衡常数K=
=0.1mol·L-1·s-1;由10s~15s内氧气浓度不变可知,该反应在10s末已经处于平衡状态,故该反应平衡常数K=![]() =0.125;
=0.125;
(2)将容器体积压缩一半,压缩瞬间,c(N2O5)=2mol/L,压强增大,化学平衡正向移动,重新达到平衡时,c(N2O5)> 2mol/L;
(3)该反应正向为放热反应,升高温度,平衡逆向移动,平衡常数减小,由此可知,T1>T2;
(4)A、容器内有颜色的气体为NO2,若容器内混合气体的颜色不再改变,则说明NO2浓度不变,可证明该反应处于平衡状态,故A正确;
B、该反应在任意时刻均存在每消耗2molN2O5会生成1molO2,故不能说明该反应处于平衡状态,故B错误;
C、混合气体的总质量不变,因反应前后气体的物质的量不相等,在反应未达到平衡时,气体的物质的量会发生变化,由![]() 可知,当混合气体的平均摩尔质量不再变化时,即反应达到平衡,故C正确;
可知,当混合气体的平均摩尔质量不再变化时,即反应达到平衡,故C正确;
D、混合气体的总质量不变,容器体积恒定,其密度不会发生改变,故不能判断该反应是否处于平衡状态,故D错误;
(5)NO2作为反应物,若要提高其转化率,可通过增加O2浓度、降低温度、增大压强、及时分离N2O5使反应正向移动达到目的;
(6)令①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol1
②2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol1
③C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol1
将反应③×2-①-②可得2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ/mol;该反应为熵减反应(![]() S<0),
S<0),![]() H<0,当
H<0,当![]() G=
G=![]() H-T
H-T![]() S<0时,该条件有利于反应的自发,由此可知,利于该反应自发进行的条件是低温。
S<0时,该条件有利于反应的自发,由此可知,利于该反应自发进行的条件是低温。

【题目】工业生产硫酸接触室发生如下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.6 | 1.2 | 1.2 |
n(O2)/mol | 0.36 | 0.36 | 0.72 | |
SO2的平衡转化率 | 80% | α1 | α2 | |
A.甲→乙,平衡向正反应方向移动,α(O2)增大,放出的热量为47.18kJ
B.平衡时,丙中c(SO2)是甲中的2倍
C.平衡时,SO2的转化率:α2>80%>α1
D.该温度下,平衡常数K=400
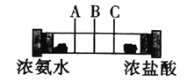
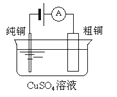
【题目】下列有关四个常用电化学装置的叙述中,正确的是![]()
![]()
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ氢氧燃料电池 |
A. 图Ⅰ所示电池中,MnO2是正极,电极反应式是2H2O+2e-=H2↑+2OH-
B. 图Ⅱ所示电池放电过程中,当外电路通过1mol电子时,理论上负极板的质量增加96g
C. 图Ⅲ所示装置工作过程中,阳极质量减少量等于阴极的质量增加量
D. 图Ⅳ所示电池中,不管KOH溶液换成H2SO4溶液还是Na2SO4溶液,电池的总反应式不变