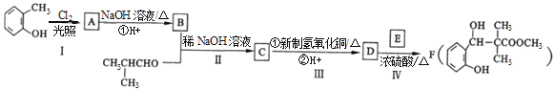
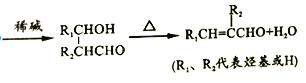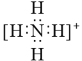��Ŀ����
����Ŀ�������й��ĸ����õ绯ѧװ�õ������У���ȷ����![]() ����
����![]()
|
|
|
|
ͼ�����п�̵�� | ͼ��Ǧ���� | ͼ���⾫��ͭ | ͼ������ȼ�ϵ�� |
A. ͼ����ʾ����У�MnO2���������缫��Ӧʽ��2H2O+2e-=H2��+2OH-
B. ͼ����ʾ��طŵ�����У������·ͨ��1mol����ʱ�������ϸ��������������96g
C. ͼ����ʾװ�ù��������У�����������������������������������
D. ͼ����ʾ����У�����KOH��Һ����H2SO4��Һ����Na2SO4��Һ����ص��ܷ�Ӧʽ����
���𰸡�D
��������
A.�����϶������̵õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪMnO2+e-+H2O=MnO(OH)+OH-��A����
B.�����ĵ缫��ӦʽΪ��Pb(s)+SO42-(aq)+2e-=PbSO4(s)�����Ե����·ͨ��1mol����ʱ�������ϸ��������������48g��B����
C.��ͭ�ľ����У������ϲ���ͭʧ���ӻ�����������ʧ���ӣ�������ֻ��ͭ���ӵõ��ӣ���ת�Ƶ������ʱ����������������������������������������C����
D.ͼ����ʾ����У�����KOH��Һ����H2SO4��Һ����Na2SO4��Һ������ܷ�Ӧʽ��Ϊ��2H2+O2=2H2O��D��ȷ��
�ʺ���ѡ����D��

����Ŀ����һ�������·�����Ӧ��4NO2(g)��O2(g)![]() 2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
ʱ��/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol��L��1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol��L��1) | 1.00 | c1 | c2 | 0.50 |
��1��0��10s��N2O5��ƽ����Ӧ����Ϊ__ �����¶��µ�ƽ�ⳣ��Ϊ___��
��2�������������䣬���������ѹ��һ�룬�����´ﵽƽ��ʱc(N2O5)___2.00mol��L��1������>��<��=������ͬ��
��3�������¶�T1ʱƽ�ⳣ��ΪK1���¶�T2ʱƽ�ⳣ��ΪK2����K1<K2����T1____T2��
��4�����п�����Ϊƽ������ݵ���___
A.�����ڻ���������ɫ���ٸı�
B.����1molO2��ͬʱ����2molN2O5
C.��������ƽ��Ħ���������ٱ仯
D.���������ܶȲ��ٱ仯
��5���ı���Щ��ʩ��������NO2��ƽ��ת����___������������������ϣ�
��6����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ��mol1
2C(s)+O2(g)=2CO(g) ��H=��221.0 kJ��mol1
C(s)+O2(g)=CO2(g) ��H=��393.5 kJ��mol1
������β�������ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=___ kJ��mol1�����ڸ÷�Ӧ�Է����е�������___��ѡ������������������������