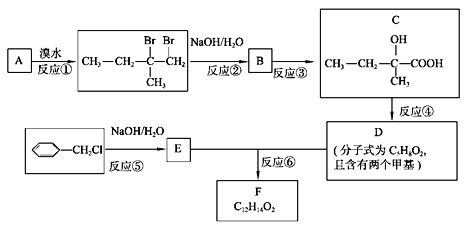
题目内容
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
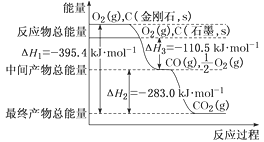
(1)在通常状况下,金刚石和石墨相比较,___(填“金刚石”或“石墨”)更稳定。
(2)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为___kJ·mol-1。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:___。
【答案】石墨 631.5 2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.0kJ·mol-1
【解析】
(1)物质的能量越高,越不稳定;
(2)根据焓变ΔH=反应物的键能之和-生成物的键能之和,计算NO分子中化学键的键能;
(3)利用盖斯定律结合已知热化学方程式计算反应热,再写出热化学方程式。
(1)根据图象,金刚石能量高于石墨,能量越低,越稳定,所以石墨稳定,故答案为:石墨;
(2)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJmol-1可设NO分子中化学键的键能为x,根据焓变ΔH=反应物的键能之和-生成物的键能之和,有:946kJmol-1+497kJmol-1-2x=180kJmol-1 ,解得:x=631.5kJmol-1,故答案为:631.5;
(3)根据图像,①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ,②C(石墨,s)+![]() O2(g)═CO(g)△H=-110.5 kJmol-1,③N2(g)+O2(g)=2NO(g)△H=+180kJmol-1,根据盖斯定律,将①×2-②×2-③得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5 kJmol-1)×2-(-110.5 kJmol-1)×2-(+180kJmol-1)=-746.0kJmol-1,故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJmol-1。
O2(g)═CO(g)△H=-110.5 kJmol-1,③N2(g)+O2(g)=2NO(g)△H=+180kJmol-1,根据盖斯定律,将①×2-②×2-③得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5 kJmol-1)×2-(-110.5 kJmol-1)×2-(+180kJmol-1)=-746.0kJmol-1,故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJmol-1。