题目内容
【题目】PbO2是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由Ca(ClO)2溶液氧化碱性Pb(OH)2法制备PbO2的步骤如下:

2Pb(CH3COO)2+4NaOH+Ca(ClO)2=2PbO2↓+4CH3COONa+CaCl2+2H2O
(1)“氧化”过程中,反应液的pH____(填“变大”“变小”或“不变”)。
(2)“硝酸洗”时,被溶解的含铅杂质可能是____________(填化学式)。
(3)产品定性检验:向Mn(NO3)2的HNO3溶液中加入少量产品,搅拌并水浴微热,溶液变紫色,说明含有PbO2。该反应的离子方程式为____(PbO2被还原为Pb2+)。
(4)为测定产品(只含PbO2和PbO)中PbO2、PbO的物质的量之比,称取产品0.5194g, 加入20.00mL0.2500mol·L-1H2C2O4溶液(PbO2还原为Pb2+)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去PbC2O4,滤液酸化后用0.0400mol·L-1KMnO4标准溶液滴定至终点(MnO![]() 还原为Mn2+,H2C2O4被氧化为CO2),消耗标准溶液10.00mL。计算产品中n(PbO2) 与n(PbO) 物质的量之比(写出计算过程)____________。
还原为Mn2+,H2C2O4被氧化为CO2),消耗标准溶液10.00mL。计算产品中n(PbO2) 与n(PbO) 物质的量之比(写出计算过程)____________。
【答案】变小 Pb(OH)2 2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O 9:2
【解析】
根据流程可知,醋酸铅与Ca(ClO)2在碱性环境下,发生氧化还原反应,生成PbO2固体和醋酸钠溶液,过滤后得到二氧化铅,由于氢氧化钠与醋酸铅也可反应生成氢氧化铅,因此二氧化铅中含有杂质氢氧化铅,硝酸洗、水洗、干燥得到产品,据此进行分析。
(1)根据2Pb(CH3COO)2+4NaOH+Ca(ClO)2=2PbO2↓+4CH3COONa+CaCl2+2H2O反应可知,反应过程中不断消耗碱,碱性减弱,“氧化”过程中,反应液的pH变小;
故答案是:变小;
(2)醋酸铅也可和氢氧化钠溶液反应生成氢氧化铅沉淀;“氧化”制得的PbO2可能含有的含铅杂质化学式是Pb(OH)2;所以“硝酸洗”时,被溶解的含铅杂质可能是Pb(OH)2;
答案是:Pb(OH)2;
(3)根据题给信息可知,反应后的紫色溶液为MnO4-,因此Mn(NO3)2的HNO3溶液与PbO2反应的离子方程式为:2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O;
故答案是:2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O;
(4)上述过程发生的反应有:6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O;PbO2+2 H2C2O4=PbC2O4+2CO2+2H2O;PbO+ H2C2O4=PbC2O4+H2O;根据反应关系可知,与高锰酸钾溶液反应的n(H2C2O4)=2.5×0.04×10×10-3=1×10-3mol;与PbO2、PbO反应的n(H2C2O4)=0.25×20×10-3-1×10-3=4×10-3mol;2n(PbO2)+n(PbO)=4×10-3mol;239g/mol×n(PbO2)+223 g/mol×n(PbO)=0.5194g,n(PbO2)=1.8×10-3mol;n(PbO)=4×10-4mol;所以产品中n(PbO2) 与n(PbO) 物质的量之比1.8×10-3mol:4×10-4mol=9:2;
故答案是:9:2。

【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
(2)在一定条件下,向2L恒容密闭容器中冲入1molCO2和3molH2发生反应②,5min时测得生成了0.4molH2O,求5min的反应速率v(H2)=__,写出一种能加快反应速率的措施___
(3)甲醇是电动汽车的理想燃料,工作原理如图所示:
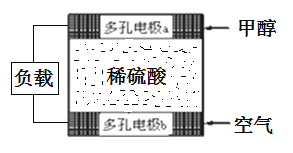
多孔电极b为燃料电池的__极(填“正”或“负”),多孔电极a发生的电极反应式为:____