题目内容
【题目】(1)热化学方程式C(s) + H2O(g) ![]() CO(g) + H2(g);△H = +131.3 kJ/mol表示________
CO(g) + H2(g);△H = +131.3 kJ/mol表示________
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸收131.3kJ 热量
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
(2)下列离子方程式中,属于水解反应的是_______________
A、CH3COOH+H2O![]() CH3COO— + H3O+ B、CO2+H2O
CH3COO— + H3O+ B、CO2+H2O![]() HCO3— + H+
HCO3— + H+
C、CO32— + H2O![]() HCO3— + OH— D、HS— + H2O
HCO3— + OH— D、HS— + H2O![]() S2— + H3O+
S2— + H3O+
(3)有A、B、C、D四块金属片,进行如下实验,
①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为___________
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
(4)在一定条件下,下列反应:2SO2 (g)+O2 (g)=2SO3 (g) ΔH<0达到平衡状态
①该反应的化学平衡常数表达式是__________________________
②其他条件不变时降低温度,二氧化硫的转化率______________,(填“增大”、“不变”、“减少”)化学反应速率_________________(填“增大”、“不变”、“减少”)
【答案】C C B ![]() 增大 减小
增大 减小
【解析】
(1)A、反应的热效应与参与反应的物质的物质的量的多少有关,未描述物质的量,状态也未描述,无法判断反应热,故A错误;B、为注明反应物和生成物的状态未标出,无法判断反应热,故B错误;C、阐明意义时既说明物质的状态又描述了物质的量的多少,故C正确;D、化学式前的计量数表示物质的量,不表示1个固态碳原子和1分子水蒸气反应吸热131.3kJ,故D错误;故选C;
(2)A、乙酸是弱酸,CH3COOH+H2O![]() CH3COO—+ H3O+是乙酸的电离方程式,故A错误;B、CO2+H2O
CH3COO—+ H3O+是乙酸的电离方程式,故A错误;B、CO2+H2O![]() HCO3—+ H+是二氧化碳与水反应的化学方程式,故B错误;C、CO32—+ H2O
HCO3—+ H+是二氧化碳与水反应的化学方程式,故B错误;C、CO32—+ H2O![]() HCO3—+ OH—是碳酸根的水解方程式,故C正确;D、HS—+ H2O
HCO3—+ OH—是碳酸根的水解方程式,故C正确;D、HS—+ H2O![]() S2—+ H3O+是硫氢根离子的电离方程式,故D错误;故选C;
S2—+ H3O+是硫氢根离子的电离方程式,故D错误;故选C;
(3)一般来说,原电池中金属活动性负极>正极材料。①A、B用导线相连后,同时插入稀H2SO4中,A极为负极,则金属活动性A>B;②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D,则C是负极、D是正极,金属活动性C>D;③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡,则C上得电子发生还原反应,C是正极、A是负极,金属活动性A>C;④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则D是负极、B是正极,金属活动性D>B;通过以上分析知,金属活动性顺序A>C>D>B,故选B;
(4)①反应2SO2 (g)+O2 (g)=2SO3 (g)的化学平衡常数表达式为K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
②ΔH<0表示是放热反应,其他条件不变时,降低温度,平衡正向移动,二氧化硫的转化率增大,化学反应速率减小,故答案为:K=![]() ;增大;减小。
;增大;减小。

【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |
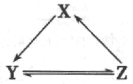
A. A B. B C. C D. D


