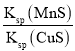题目内容
【题目】25 ℃时,向10 mL 0.1 mol·L-1一元弱碱XOH溶液中逐滴滴加0.1 mol·L-1的盐酸,溶液的AG[AG=lg![]() ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
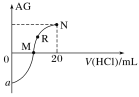
A.若a=-8,则Kb(XOH)≈10-6
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度先增大后减小
【答案】AB
【解析】
A. a点表示0.1 mol·L-1的XOH,若a=8,则c(OH)=103 mol·L-1,所以Kb(XOH)= ![]() ≈105,A项错误;
≈105,A项错误;
B. M点AG=0,则溶液中c(OH)=c(H+),溶液呈中性,所以溶液中为XOH、XCl,二者没有恰好反应,B项错误;
C. 若R点恰好为XCl时,根据物料守恒可得:c(X+)+c(XOH)=c(C1),C项正确;
D. M点的溶质为XOH和XCl,继续加入盐酸,直至溶质全部为XCl时,该过程水的电离程度增大,然后XCl溶液中再加入盐酸,水的电离程度减小,所以从M点N点,水的电离程度先增大后减小,D项正确;
答案选AB。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目