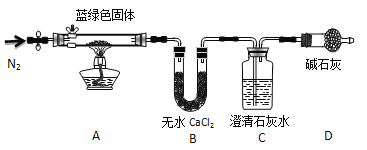
题目内容
【题目】X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
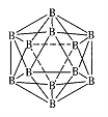
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H =" -1160" kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
【答案】(1)第三周期ⅠA族;N3—+ 3H2O NH3+3OH—
(2)大;[Ar]3d54s2
(3)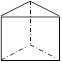 ,SP3杂化
,SP3杂化
(4)MnO4—+ 5Fe2++8 H+=Mn2++5Fe3++4 H2O
(5)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH= -867kJ·mol-1
【解析】试题分析:根据题给信息推断X为氢元素,Y为碳元素,Z为氮元素,W为钠元素,G为锰元素。
(1)W为钠元素,在元素周期表中的位置是第三周期ⅠA族;Na3N水溶液呈碱性的原因N3—与水电离产生的氢离子结合生成NH3,水的电离平衡正向移动,使得溶液中氢氧根浓度大于氢离子浓度,溶液呈碱性,离子方程式为N3—+ 3H2O NH3+3OH—。
(2)氧原子的价电子排布为2s22p4,氮原子的价电子排布为2s22p3,p轨道处于半充满状态,较稳定,故氮原子的第一电离能比氧原子的大;G为锰元素,原子序数为25,根据构造原理知其基态原子电子排布式是[Ar]3d54s2。
(3)C6H6分子中只有σ键,该分子的结构简式是 ;碳原子形成3个σ键,没有孤对电子,杂化轨道类型是sp3。
;碳原子形成3个σ键,没有孤对电子,杂化轨道类型是sp3。
(4)酸性高锰酸钾溶液将Fe2+氧化为Fe3+,本身被还原为Mn2+,利用化合价升降法结合原子守恒和电荷守恒配平,该反应的离子方程式是MnO4—+ 5Fe2++8 H+=Mn2++5Fe3++4 H2O。
(5)已知:①CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=" -" 574 kJ·mol-1,②CH4(g)+4NO(g)=2N2(g)十CO2(g) +2H2O(g) △H =" -1160" kJ·mol-1,根据盖斯定律:(①+②)÷2得CH4还原NO2至N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH= -867kJ·mol-1。