题目内容
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
(1)2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1(热化学方程式和反应热各1分)
(2)318.1 kJ(未写单位不得分)
(3)N2H4-4e-+4OH- = N2+4H2O O2+4e-+2H2O = 4OH-
(4)2NH3+ClO-= N2H4+Cl-+H2O
(2)318.1 kJ(未写单位不得分)
(3)N2H4-4e-+4OH- = N2+4H2O O2+4e-+2H2O = 4OH-
(4)2NH3+ClO-= N2H4+Cl-+H2O
试题分析:(1)已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。则2mol液态肼放出的热量为219.3 kJ×5=1096.5 kJ
所以反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
所以有反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(l) ΔH=-1272.5kJ·mol-1
16 g气态肼的物质的量="16g/32g/mol=0.5mol," 放出的热量Q=1272.5 kJ /4="318.1" kJ
(3)由肼和空气构成的碱性燃料电池的负极反应式为:N2H4-4e-+4OH- = N2+4H2O 正极反应式为:O2+4e-+2H2O = 4OH-
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼, 次氯酸钠是氧化剂,被还原为氯化钠,氨气做还原剂,被氧化为肼。2NH3+ClO-= N2H4+Cl-+H2O

练习册系列答案
相关题目
 H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2; CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,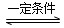 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
 2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 始终保持增大
始终保持增大 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下: 2B(g)在前110 s内的反应进程。
2B(g)在前110 s内的反应进程。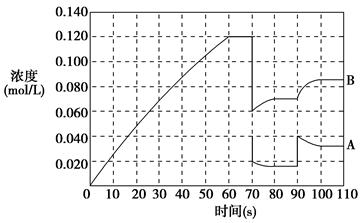
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表: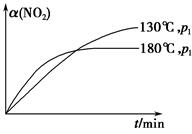
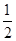 O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。
O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。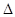 H= -Q1 kJ/mol;
H= -Q1 kJ/mol;