题目内容
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
I.(1)用甲醇制取甲胺的反应为![]() △H
△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=__________kJ·mol-1
Ⅱ.一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应
主反应:![]() △H<0 Ⅰ
△H<0 Ⅰ
副反应:![]() △H<0 Ⅱ
△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)如图所示:
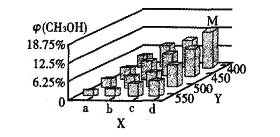
(2)图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是__________
(3)若反应II的平衡常数K值变小.则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动
B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小
D.容器中φ(CH3OCH3)增大
(4)平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为________;用H2表示I的反应速率为______mol·L-1·min-1。反应Ⅱ的平衡常数K=___________(用分数表示)
【答案】-12 小于 随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度 BC 56% ![]()
![]()
【解析】
(1)反应热=反应物总键能-生成物总键能;
(2) 根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,结合平衡移动原理回答;
(3) 反应II为放热反应,若反应II的平衡常数K值变小,说明平衡逆向移动,温度升高;
(4)平衡时,c(CH3OCH3)=0.1mol·L-1,则n(CH3OCH3)=0.2mol,根据![]() ,分解的CH3OH为0.4mol,生成的水为0.2mol,根据三段式计算解答。
,分解的CH3OH为0.4mol,生成的水为0.2mol,根据三段式计算解答。
I.(1)设C-H的键能为x,反应CH3OH(g)+NH3(g)═CH3NH2(g)+H2O(g)的△H=反应物总键能-生成物总键能=(3x+351+463+393×3-3x-293-393×2-463×2)kJ/mol=-12kJ/mol,故答案为:-12;
Ⅱ.(2)根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度,故答案为:小于;随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度;
(3) 反应II为放热反应,若反应II的平衡常数K值变小,说明平衡逆向移动,温度升高。A.反应II为放热反应,若反应II的平衡常数K值变小,说明平衡逆向移动,故A错误; B.平衡常数只与温度有关,反应II为放热反应,若反应II的平衡常数K值变小,说明平衡逆向移动,故B正确;C.温度升高,CO(g)+2H2(g)CH3OH(g)△H<0,平衡逆向移动,达到新平衡后,φ(CH3OH)减小,故C正确;D.![]() ,平衡逆向移动,导致CO(g)+2H2(g) CH3OH(g) △H<0,平衡逆向移动,容器中气体的总物质的量增大,容器中φ(CH3OCH3)减小,故D错误;故答案为:BC;
,平衡逆向移动,导致CO(g)+2H2(g) CH3OH(g) △H<0,平衡逆向移动,容器中气体的总物质的量增大,容器中φ(CH3OCH3)减小,故D错误;故答案为:BC;
(4)平衡时,c(CH3OCH3)=0.1mol·L-1,则n(CH3OCH3)=0.2mol,根据![]() ,分解的CH3OH为0.4mol,生成的水为0.2mol,设CO的转化量是x。
,分解的CH3OH为0.4mol,生成的水为0.2mol,设CO的转化量是x。
CO(g)+2H2(g)CH3OH(g);
初始量(mol): 2 6 0
变化量(mol): x 2x x
平衡量(mol):2-x 6-2x x-0.4
平衡时,CH3OH的体积分数为12.5%,则![]() ×100%=12.5%,解得x=1.12 mol ,所以CO的转化率为
×100%=12.5%,解得x=1.12 mol ,所以CO的转化率为![]() ×100%=56%,用H2表示I的反应速率=
×100%=56%,用H2表示I的反应速率=![]() =
=![]() mol·L-1·min-1;反应Ⅱ的平衡常数K=
mol·L-1·min-1;反应Ⅱ的平衡常数K=![]() =
=![]() ,故答案为:56%;
,故答案为:56%;![]() ;
;![]() 。
。

【题目】滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4




