��Ŀ����
����Ŀ����.��1���������Ķ�������Ͷ�����̼�����ǵ����ʵ���֮��___������ԭ����֮��Ϊ___��ͬ��ͬѹ�µ��ܶ�֮��Ϊ___��
��2������ԭ������ȵļ���Ͱ�����NH3��������֮��Ϊ___��
��3��3.22g��Na2SO4��10H2O����ˮ�У�Ҫʹÿ100�������к���1��Na+������Ҫˮ������Ϊ___��
��4��ͬ��ͬѹ��ij��������������64g������������52g�����ڳ���ij������66g����������Ħ������Ϊ___��
��.��1���ͻ��������Ϻ���ij�ְ�ɫǦ������������ڿ����г�ʱ���ͻ��ɺ�ɫPbS���Ӷ�ʹ�ͻ���ɫ�ʱ䰵������˫��ˮH2O2����ϴ����ɽ�PbS���PbSO4���Ӷ�ʹ�ͻ���ԭ��������ϴ��Ӧ�Ļ�ѧ����ʽΪPbS+4H2O2=PbSO4+4M������ƽ����
������M�Ļ�ѧʽΪ___ ��������ת�Ƶĵ�����Ŀ4molʱ���μӷ�Ӧ��H2O2������Ϊ___��
��2���ڷ�Ӧ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O�У���������___������������___�����������뻹ԭ�������ʵ���֮����___���������ͻ�ԭ�������ʵ���֮��Ϊ___������36.5gHCl�������������Cl2������Ϊ___��
��3��2.3g�Ľ����ƣ��ڸ���Ŀ����б�������õ����������Ϊ3.5g����Ӧ������������Ƶ�����Ϊ___��
��4����ƽ���з���ʽ���õ����ű�ʾ���ӵ�ת�ƣ�����д����ƽ���̣�___
Cu+HNO3(ϡ)=Cu(NO3)2+NO��+H2O
���𰸡�11��16 11��16 16��11 12��17 34.2g 32g/mol H2O 68g KMnO4 Cl2 5��2 1��5 35.5g 1.55g ![]()
��������
��.��1������n=![]() =
=![]() ��ͬ��ͬѹ�£�������ܶ�֮�ȵ�����Է�������֮�ȼ��㣻
��ͬ��ͬѹ�£�������ܶ�֮�ȵ�����Է�������֮�ȼ��㣻
��2������n=![]() �����ʽṹ������
�����ʽṹ������
��3��Ҫʹÿ100��ˮ����������1��Na+����ˮ�������ӵ����ʵ���֮��Ϊ100��1��ע��ˮ�������Ծ��壻
��4��ͬ��ͬѹ�£���ͬ�ݻ�ʱ����������ʵ�����ͬ������������ʵ���Ϊn����������Ϊm��������������������He���������з��̼���n��m��ֵ������M=![]() �ɼ��������Ħ���������ݴ˼����������Է���������
�ɼ��������Ħ���������ݴ˼����������Է���������
��.��1��PbS+4H2O2=PbSO4+4M�У��������غ㶨�ɵó�M�ķ���ʽ�����������ԭ��Ӧ�Ĺ��ɷ�������
��2������������ԭ��Ӧ�Ĺ�������
��3���õ�����Ϊ�����ƺ������ƵĻ�������Ԫ���غ��г���ϵʽ������
��4����ϵ���ת�����غ�����
��.��1�����������Ͷ�����̼��������Ϊm������Ե����ʵ����ֱ�Ϊ![]() ��
�� ![]() ���������ʵ���֮��Ϊ
���������ʵ���֮��Ϊ![]() ��
��![]() =11��16������ԭ����֮��Ϊ
=11��16������ԭ����֮��Ϊ![]() ��
��![]() =11��16��ͬ��ͬѹ�£�������ܶ�֮�ȵ�����Է�������֮��Ϊ64:44=16��11���ʴ�Ϊ��11��16��11��16��16��11��
=11��16��ͬ��ͬѹ�£�������ܶ�֮�ȵ�����Է�������֮��Ϊ64:44=16��11���ʴ�Ϊ��11��16��11��16��16��11��
��2�������Ͱ�����NH3������ԭ������Ϊa��������ӵ����ʵ���֮��Ϊ![]() =3��4����������֮��Ϊ(3
=3��4����������֮��Ϊ(3![]() 16):(4
16):(4![]() 17)= 12��17���ʴ�Ϊ��12��17��
17)= 12��17���ʴ�Ϊ��12��17��
��3��n��Na2SO410H2O��=![]() =0.01mol��n��Na+��=0.02mol����ˮ�������ʵ���Ϊ0.02mol��100=2mol�����о��庬�ᾧˮ�����ʵ���Ϊ0.01mol��10=0.1mol�������ˮ�����ʵ���Ϊ2mol-0.1mol=1.9mol������ˮ������Ϊ1.9mol��18g/mol=34.2g���ʴ�Ϊ��34.2g��
=0.01mol��n��Na+��=0.02mol����ˮ�������ʵ���Ϊ0.02mol��100=2mol�����о��庬�ᾧˮ�����ʵ���Ϊ0.01mol��10=0.1mol�������ˮ�����ʵ���Ϊ2mol-0.1mol=1.9mol������ˮ������Ϊ1.9mol��18g/mol=34.2g���ʴ�Ϊ��34.2g��
��4������������ʵ���Ϊn����������Ϊm����m+n��28g/mol=114g��m+n��4g/mol=102g���������̽��n=0.5mol��m=100g����������������Ϊ116g���������������Ϊ![]() =32g/mol���ʴ�Ϊ��32g/mol��
=32g/mol���ʴ�Ϊ��32g/mol��
��.��1��PbS+4H2O2=PbSO4+4M�У��������غ㶨�ɿ�֪��MΪH2O���ʴ�Ϊ��H2O��
1mol H2O2��Ӧת��2mol���ӣ�����ת�Ƶĵ�����Ŀ4molʱ���μӷ�Ӧ��H2O2������Ϊ2mol![]() 34g/mol=68g���ʴ�Ϊ��68g��
34g/mol=68g���ʴ�Ϊ��68g��
��2���ڷ�Ӧ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O�У� MnԪ�صĻ��ϼ۴�+7�۽��͵�+2�ۣ��õ�5�����ӣ�������������������Ȼ����ǻ�ԭ�����Ԫ�صĻ��ϼ۴�-1�����ߵ�0�ۣ�ʧȥ1�����ӣ��Ȼ����ǻ�ԭ����������������������������뻹ԭ�������ʵ���֮����5:2�����ݷ���ʽ��֪16mol�Ȼ���μӷ�Ӧ��������ԭ������10mol�����������ͻ�ԭ�������ʵ���֮��Ϊ2:10=1:5�����ݹ�ϵʽ10HCl����������![]() 5Cl2��֪������36gHCl�������������Cl2������Ϊ
5Cl2��֪������36gHCl�������������Cl2������Ϊ![]() =35.5g���ʴ�Ϊ��5:2��1:5��35.5g��
=35.5g���ʴ�Ϊ��5:2��1:5��35.5g��
��3���Ƶ����ʵ���Ϊ0.1mol����������ȫΪNa2O��������Ϊ0.05mol��62g��mol-1= 3.1g��3.5g����������ȫΪNa2O2��������Ϊ0.05mol��78g��mol-1=3.9g��3.5g������������ΪNa2O��Na2O2�Ļ��������ɵ�Na2OΪxmol��Na2O2Ϊymol������62x+78y=3.5g�٣�x+y=![]() =0.05mol�ڣ��������̽��x=y=0.025mol����Ӧ������������Ƶ�����Ϊ0.025mol��62g��mol-1=1.55g���ʴ�Ϊ��1.55g��
=0.05mol�ڣ��������̽��x=y=0.025mol����Ӧ������������Ƶ�����Ϊ0.025mol��62g��mol-1=1.55g���ʴ�Ϊ��1.55g��
��4���÷�Ӧ��Ԫ�صĻ��ϼ۵ı仯Ϊ��HNO3��NO����Ԫ����+5����+2�ۣ�һ����ԭ�ӵ�3�����ӣ���������������Cu��Cu(NO3)2��ͭԪ����0����+2�ۣ�һ��ͭԭ��ʧ2�����ӣ���������С������Ϊ6��һ�������ļ�����Ϊ2��ͭ�ļ�����Ϊ3��Ȼ���ٸ���ԭ���غ���ƽ����ʽ�ɵû�ѧ����ʽΪ�� ![]() ��
��

����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����л��ϳ��о��й㷺Ӧ�á�
I��(1)�ü״���ȡ�װ��ķ�ӦΪ![]() ��H
��H
��֪�÷�Ӧ����ػ�ѧ���ļ����������£�
���ۼ� | C�DO | H�DO | N�DH | C�DN |
���ܣ�kJ��mol-1 | 351 | 463 | 393 | 293 |
��÷�Ӧ����H=__________kJ��mol-1
����һ�������£���2mol CO��6mol H2ͨ��2L�ܱ������з������·�Ӧ
����Ӧ��![]() ��H<0 ��
��H<0 ��
����Ӧ��![]() ��H<0 ��
��H<0 ��
��Ӧ��t minʱ���ﵽƽ��״̬��ƽ��ʱCH3OH�����������(CH3OH)��ͼ��ʾ��
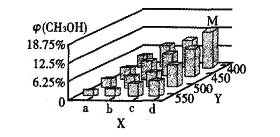
(2)ͼ��a___b(��������������С����)��ͼ��Y���ʾ�¶ȣ���������__________
(3)����ӦII��ƽ�ⳣ��Kֵ��С��������˵������ȷ����___________(�����)��
A��ƽ���������Ӧ�����ƶ�
B��ƽ���ƶ���ԭ�����������¶�
C���ﵽ��ƽ�����(CH3OH)��С
D����������(CH3OCH3)����
(4)ƽ��ʱ��M��CH3OH���������Ϊ12.5����c(CH3OCH3)=0.1mol��L-1�����ʱCO��ת����Ϊ________����H2��ʾI�ķ�Ӧ����Ϊ______mol��L-1��min-1����Ӧ����ƽ�ⳣ��K=___________(�÷�����ʾ)

